4.薬品・バイオ業界への影響
オプジーボの薬価について、小野薬品工業には何の責任もありません。日本の薬価は厚生労働省が決めており、製薬メーカー側に決定権はありません。製薬メーカーが日本で事業をしようというのであれば、国が決めた薬価制度と厚生労働省が決めた薬価を受け入れるしかないのです。
ところが、明らかに割高な価格を設定させられて、それが高すぎると分った途端に今度は大幅値下げになり、制度が全く異なる欧州での価格との比較まで出てくるとなると、日本に新薬を投入しようという製薬メーカーの開発意欲が大きく阻害されることになるかもしれません。また、高額医薬品の中には再生医療等製品(再生医療をベースにした医薬品、医療用製品)も含まれますが、これが次のターゲットになる可能性もあります。各種報道を見ると、日本の医薬品開発現場の士気低下と、再生医療が次の値下げターゲットになりかねないことを危惧する報道が見られます。
ただし、日本の薬価制度では、赤字になるまで薬価を引き下げることはありません。実際に赤字になった場合は、薬価を引き上げて黒字にする例があります。このような状況で、新薬開発意欲が萎えると、先行した製薬メーカー、がん領域では小野薬品工業の立場が有利になると思われます。
5.注目される臨床試験
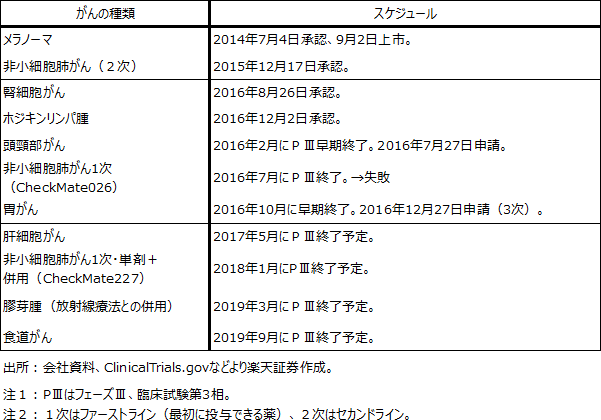
小野薬品のこれまでの臨床試験で失敗したのは、非小細胞肺がんファーストライン(オプジーボ単剤)で、PD-L1発現率5%以上の患者を対象としたCheckMate026試験だけです。大きな失敗ではありますが、非小細胞肺がんファーストライン向けではCheckMate227試験が継続しています。こちらのほうが併用試験でもあり重要です。また、他のがんへの試験は今のところ全て成功しています。
CheckMate227
CheckMate227試験は、BMSが主導する国際共同治験であり、非小細胞肺がんファーストラインの試験です。現在フェーズⅢです。
この試験は、オプジーボ単剤と、オプジーボと他剤との併用を比較する試験です。即ち、
●オプジーボ単剤
●オプジーボ+ヤーボイ
●オプジーボ+カルボプラチン(一般名)、シスプラチン(同)、ゲムシタビン(同)、ペメトレキセド(同)のいずれかの併用
●ゲムシタビン+シスプラチンまたはゲムシタビン+カルボプラチン(扁平上皮がんの場合)、ペメトレキセド+シスプラチンまたはペメトレキセド+カルボプラチン(非扁平上皮がんの場合)
の組み合わせを比較します。特徴は、併用剤として免疫チェックポイント阻害剤のヤーボイだけでなく、非小細胞肺がんの治療で一般的に使われている化学療法剤(カルボプラチン、シスプラチン、ゲムシタビン、ペメトレキセド)が採用されていることです。また、オプジーボ+ヤーボイの併用はPD-L1発現率1%以上の患者が対象となりますが、オプジーボ+ヤーボイ、オプジーボ+化学療法剤の比較ではPD-L1が発現していない患者が対象になります。
オプジーボが既存の標準薬との併用でより効くのであれば、他のがん種にも応用できる可能性があると思われます。低コストで奏効率等の数値を上げることができることになります。
ClinicalTrials.govに記載されているCheckMate227試験の期間は2015年8月~2018年1月です。今後の進捗が注目されます。
初発のMGMT(腫瘍内O-6-メチルグアニンDNAメチルトランスフェラーゼ)非メチル化成人膠芽腫患者を対象に、放射線療法をそれぞれ併用し、ニボルマブとテモゾロミドを比較する無作為化第3相非盲検試験
小野薬品工業とBMSの共同試験であり、膠芽腫(こうがしゅ)に対するオプジーボと放射線療法との併用試験です。現在フェーズⅢで、試験期間は2016年1月~2019年3月です。
膠芽腫は、脳の神経細胞を支える神経膠細胞が腫瘍化したもので、悪性の腫瘍です。放射線療法には、放射線を照射した場所から離れたところにあるがんが縮小する現象が観察されています。これを放射線のアブスコパル効果と呼びます。放射線照射によって破壊されたがん細胞から放出されるがん抗原によって活性化された細胞障害性T細胞が、全身を巡ってがん細胞を攻撃するという仕組みです。この仕組みをオプジーボとの併用によって強化しようとするものです。この試験も既存の放射線治療との併用ですから、成功すれば低コストで奏効率や生存期間を延長することが可能になると思われます。
キイトルーダの脅威
一方で、メルクの「キイトルーダ」がオプジーボにとって脅威になりつつあります。これまでのキイトルーダのメラノーマ向け、非小細胞肺がん向けは、PD-L1発現率50%以上という制約があったため、たとえファーストラインであっても、投与患者数はオプジーボに比べて限られていました。
ところが、メルクはPD-L1発現率の制限がないキイトルーダと化学療法剤との併用療法(非小細胞肺がんファーストライン)をFDA(アメリカ食品医薬品局)に申請し、2017年1月10日付けで受理されました。2016年11月にフェーズⅡが終了したKEYNOTE-021試験をベースにして申請しました。2017年5月10日までにFDAが可否を決めます。これが承認されると、アメリカではオプジーボに対して脅威となる可能性があります。小野薬品工業が受け取るBMSからのロイヤルティにも影響が出る可能性もあります。
ただし日本では、今年2月にキイトルーダが薬価収載されると思われますが、非小細胞肺がんについてはセカンドラインからのスタートになります。また、キイトルーダ上市後にファーストラインが承認されたとしても、今の高価格では既存薬を早期に置き換えることは難しいと思われます。厚生労働省はオプジーボ、キイトルーダなどの高額医薬品の使用について最適使用ガイドラインを策定中であり、価格が十分下がるまでは厳格な使用基準が適用されると思われるからです。
ここでも、BMS=小野薬品が進めているCheckMate227試験が重要になります。この試験が成功すれば、キイトルーダに対して十分対抗できると思われます。
表1 オプジーボの臨床試験スケジュール(主なもの)













![[動画で解説]成長株、割安株、高配当利回り株…どの株を選べばいい?](https://m-rakuten.ismcdn.jp/mwimgs/8/4/498m/img_84b60a4da51373f73b5c52275b097f2837381.jpg)













![[動画で解説]桐谷さんの優待生活に突撃!#1~桐谷さん、おきに優待ベスト3見せてください!~](https://m-rakuten.ismcdn.jp/mwimgs/9/5/498m/img_9528c8c2f23001a3deb43de0c6f7845872398.jpg)




















![[今週の日経平均]最高値更新も「天井サイン」出現!今週の日本株どうなる?!](https://m-rakuten.ismcdn.jp/mwimgs/2/b/160m/img_2b5a074cc6a3e935645125fb974dffcf59165.jpg)


![[動画で解説]みずほ証券コラボ┃7月16日【米株は小型選別 日本株はドル建てに注目~今週は米共和党大会と米決算発表~】みずほウィークリーVIEW 中島三養子](https://m-rakuten.ismcdn.jp/mwimgs/2/a/498m/img_2a5df0131378bd46a83ce1f01fbb418d92438.jpg)
![[動画で解説]【テクニカル分析】今週の日本株 最高値を更新後日本株はどうなる?~出現した「天井サイン」をどう読むか~<チャートで振り返る先週の株式市場と今週の見通し>](https://m-rakuten.ismcdn.jp/mwimgs/6/0/498m/img_60df7a3c9e52ac000de20f75f870968d71371.jpg)
![[動画で解説]円高ショックで日経平均急落、夏枯れ相場始まり?](https://m-rakuten.ismcdn.jp/mwimgs/3/c/498m/img_3c55226b36153bdd05e3d3a674f68f9245072.jpg)
![[動画で解説]新NISAを使った個別株投資について](https://m-rakuten.ismcdn.jp/mwimgs/0/c/498m/img_0c14e3a2b5e84beb52872a9b879aa3e795587.jpg)

















![[今週の日経平均]最高値更新も「天井サイン」出現!今週の日本株どうなる?!](https://m-rakuten.ismcdn.jp/mwimgs/6/c/356m/img_6c199645af38ea98963a94af8b6f3b6934054.jpg)

























![[動画で解説]日銀が7月利上げに踏み切るべきでないこれだけの理由](https://m-rakuten.ismcdn.jp/mwimgs/a/8/160m/img_a8715b638366eed8a8f8d75613b8e92163161.jpg)



