毎週金曜日夕方掲載
本レポートに掲載した銘柄
1.免疫チェックポイント阻害薬とは何か
今年のノーベル生理学・医学賞に京都大学の本庶佑(ほんじょ・たすく)特別教授と、米テキサス大学のジェームス・アリソン教授の二人が選ばれました。二人とも免疫チェックポイント阻害薬開発の元になった研究が受賞理由であり、本庶特別教授はPD-1、アリソン教授はCTLA-4の研究で知られています。
そこで今回は免疫チェックポイント阻害薬「オプジーボ」と小野薬品工業の最近の動向を見て行きたいと思います。
最初に、オプジーボとは何かを簡単に復習します。
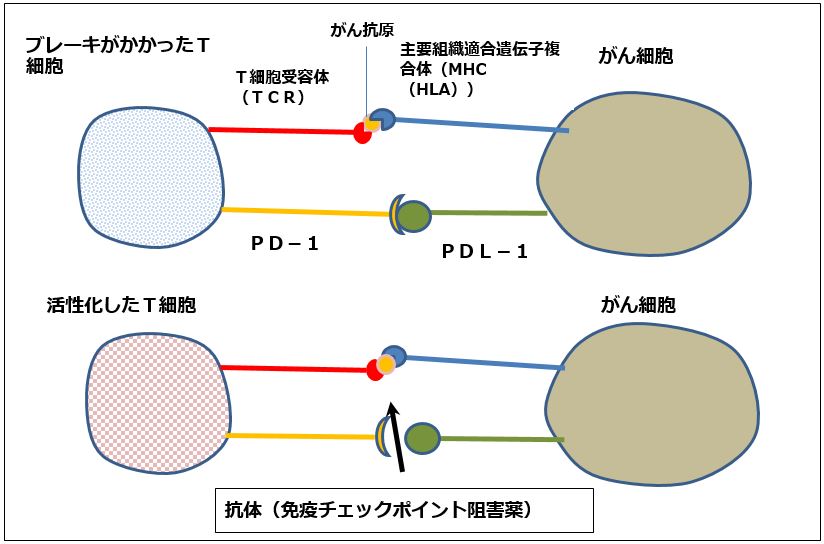
人間の体には「免疫」があり、免疫細胞(T細胞)が体外から入ってきた異物、病原菌や、体内で細胞が変化して出来た「がん細胞」を検知して、これらを取り囲んで殺したり、動かなくしたり、体外に排除する働きをします。
ところが、T細胞の働きが悪く、がん細胞を抑え込むことが出来なくなると、がん細胞の表面にある「PD-L1」あるいは「PD-L2」という分子が、T細胞の「PD-1」と結合し、T細胞の動作を止めてしまい、免疫を効かなくします。これを「がん免疫逃避機構」と言います。この結果、がん細胞が増殖し、画像でも明らかな「がん」となるのです(図1)。
これに対して免疫チェックポイント阻害薬は、T細胞のPD-1またはPD-L1にふたをかぶせ、がん細胞のPD-L1とT細胞のPD-1とのつながりを阻害します(働かなくします)。この結果、免疫が再び元に戻り、がんを撃退することが出来ます。この発見は、今年のノーベル賞を受賞した本庶特別教授によってなされ、小野薬品工業と本庶特別教授とが共同研究して、免疫チェックポイント阻害薬「オプジーボ」(一般名ニボルマブ)が生まれました。
なお、それに先立ってテキサス大学のアリソン教授が研究したCTLA-4を阻害する最初の免疫チェックポイント阻害薬「ヤーボイ」(一般名イピリムマブ)が、ブリストル・マイヤーズ スクイブ(以下BMS)によって開発されました。
オプジーボはバイオ医薬品であり、小野薬品工業はバイオ医薬品の製造技術をもっていないため、アメリカのバイオベンチャー、メダレックス社と2005年に提携しましたが、そのメダレックス社が2009年にBMSに買収されたため、2011年に小野薬品工業とBMSはオプジーボに関して全面提携しました。
図1 免疫チェックポイント阻害薬の働き方
2.免疫チェックポイント阻害薬にはいくつか種類がある
免疫チェックポイント阻害薬にはいくつかの種類があります。
1)PD-1=PD-L1の繋がりのPD-1を阻害するもの:「オプジーボ」(小野薬品工業=BMS、一般名「ニボルマブ」、日米欧で各種がん用に承認済み)、「キイトルーダ」(米メルク、一般名「ペムブロリズマブ」、欧米で各種がん用に承認済み、日本では非小細胞肺がんファーストライン(ステージⅣで最初に使うことが出来る薬)で承認済み)
2)同じくPD-L1を阻害するもの:「テセントリク」(ロシュ=中外製薬、一般名「アテゾリズマブ」、アメリカで承認済み、日本では非小細胞肺がんで承認済み)、「イミフィンジ」(アストラゼネカ、一般名「デュルバルマブ」、アメリカで承認済み、日本では非小細胞肺がんで承認済み)。
3)T細胞上に発現するCTLA-4を阻害するもの:「ヤーボイ」(BMS、最初の免疫チェックポイント阻害薬、一般名「イピリムマブ」、日米欧でメラノーマ用に承認済み)。
この中で最も先行し、安定的に効き、適応範囲が拡大しているのがPD-1阻害剤の「オプジーボ」であり、それに続いているのが「キイトルーダ」です。
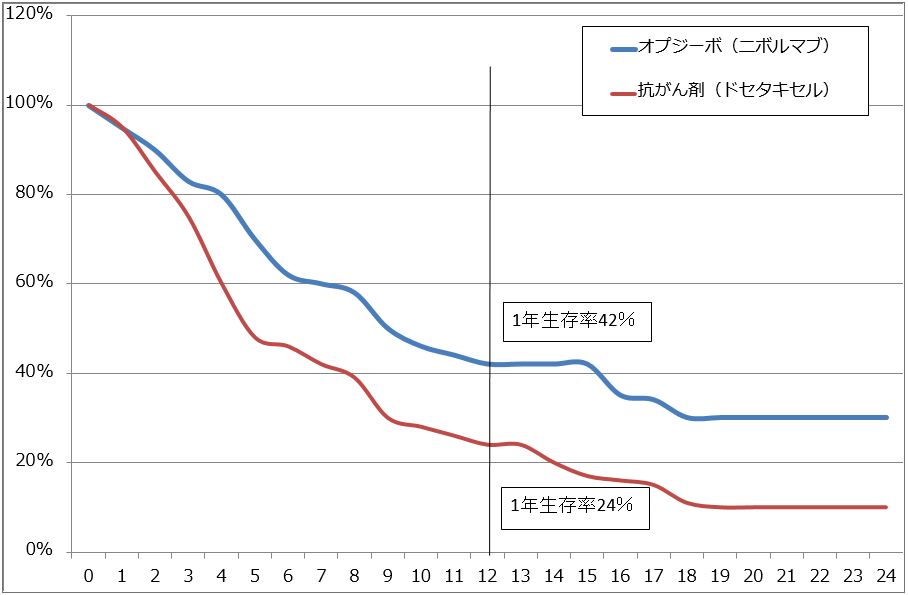
オプジーボがどの程度がんに効く薬なのかを表したものが図2です。図2はオプジーボ単剤による非小細胞肺がんセカンドライン(非小細胞肺がんステージⅣで、ファーストラインとして使った抗がん剤が効かなかった場合にオプジーボを使う)の生存率を表したものですが、1年生存率42%、2年生存率約30%となっています。他のがん種を見ても、2年生存率がおおむね20~30%という結果になっています。そして、この20~30%の患者が長期延命する可能性があります。
図2 オプジーボの治療成績:模式図
3.オプジーボの適応拡大が進む
オプジーボは、日本では2014年7月に悪性黒色腫(メラノーマ)の治療薬として初めて承認されました。その後、非小細胞肺がん2次(セカンドライン)、腎細胞がん2次、ホジキンリンパ腫、頭頸部がん2次、胃がん3次(サードライン)、悪性胸膜中皮腫と次々に新しいがん種で承認を得ました。現在は、肝細胞がん1次(ファーストライン)の申請を前にしているところです。
また、今後重要になるオプジーボと併用剤の投与については、悪性黒色腫、腎細胞がんについてヤーボイとの併用が承認されています。
臨床試験では、後述の非小細胞肺がん1次(CheckMate227)の他、膠芽腫(放射線療法との併用)、食道がん1次(ヤーボイとの併用)、食道がん2次、胃がん1次(化学療法剤との併用)、胃がん1次(ヤーボイとの併用)、卵巣がん2次などが注目されます。特に、非小細胞肺がん1次と胃がん1次は対象患者数が多いため、承認されると投与人数の大幅拡大に繋がります(非小細胞肺がん1次の対象患者数は約4.5~5万人、胃がん1次は2.5万人。ただし、実際に投与される人数はこの中の一部となる)。
併用剤の探索も重要です。現時点ではヤーボイとの併用のみが承認されていますが、日本でエーザイの「レンビマ」との肝細胞がんへの併用や、武田薬品工業が日本での独占販売権を持つ「cabozantinib」との併用に関して、エーザイ、武田薬品工業と提携しています。また従来の化学療法剤(通常の抗がん剤)との併用試験も様々ながん種で進行中です。
表1 オプジーボの臨床試験スケジュール(主なもの)
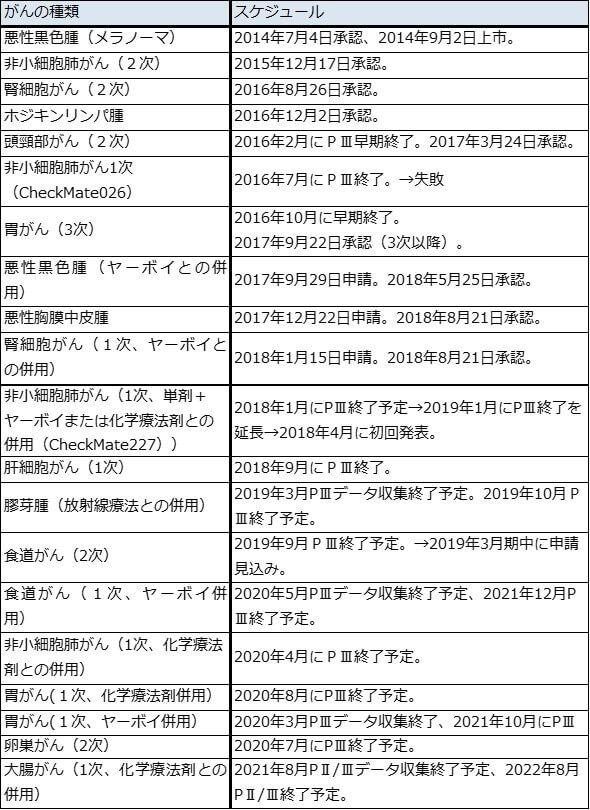
注1:PⅢはフェーズⅢ、臨床試験第3相
注2:1次はファーストライン(最初に投与できる薬)、2次はセカンドライン
表2 オプジーボ新規処方患者数(小野薬品推定)
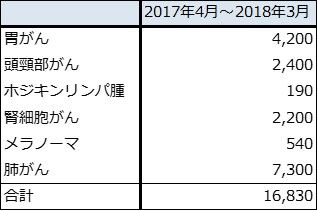
出所:会社資料より楽天証券作成
4.CheckMate227は主要評価項目を変えて申請したい意向
投与人数の大きさから見て、非小細胞肺がん1次の臨床試験であるCheckMate227(小野薬品工業とBMSの共同試験)は小野薬品工業にとって最も重要です。CheckMate227の中身は、BMSのプレスリリースによれば以下の通りです。
Part 1a:PD-L1 陽性患者を対象に、オプジーボと低用量のヤーボイの併用療法またはオプジーボ単剤療法を化学療法と比較評価。
Part 1b:PD-L1 陰性患者を対象に、オプジーボと低用量のヤーボイの併用療法またはオプジーボと化学療法の併用療法を化学療法と比較評価。
Part 2:PD-L1 または腫瘍遺伝子変異量(TMB)の状態にかかわらず、オプジーボと化学療法の併用療法を化学療法と比較評価。
Part 1 の主要評価項目は、オプジーボと低用量のヤーボイの併用療法(化学療法と比較評価)について、一つはPD-L1 陽性患者における全生存期間(OS)(Part1a に組み入れられた患者で評価、最終評価まで継続)です。もう一つは、PD-L1 発現の有無にかかわらずTMBが10mut/Mb以上の患者における無増悪生存期間(PFS)(Part1a および1bに組み入れられた患者で評価)です。
Part 2 の主要評価項目はOS です。
CheckMate227の主要評価項目は、本来は全生存期間(OS)だったはずですが、BMSが非小細胞肺がん1次の申請を欧州、アメリカで行った際には、上記の腫瘍遺伝子変異量(TMB)が高い患者の無増悪生存期間(PFS)が主要評価項目になっています。すなわち、「腫瘍遺伝子変異量(TMB)が10変異/メガベース(mut/Mb)以上のファーストラインの進行非小細胞肺がん(NSCLC)患者に対するオプジーボ(一般名:ニボルマブ)と低用量のヤーボイ(一般名:イピリムマブ)の併用療法」について、欧州医薬品庁(EMA)、アメリカFDAに対して申請し、受理されました(EMAは2018年5月3日申請受理、FDAは2018年6月21日申請受理)。このうちFDAの審査終了目標期日は2019年2月20日です。
ここでTMBは、がん細胞における遺伝子変異の総量を示す定量的バイオマーカーで、これが高レベルの場合、免疫療法薬が患者に対して効くと予測できる可能性があります。
欧州とアメリカで非小細胞肺がん1次の申請が受理されたため、日本ではPDMA(医薬品医療機器総合機構)と小野薬品工業との間で、OSではなくTMBが高い患者のPFSを主要評価項目とした申請が認められるかどうかについて協議しているもようです。アメリカで申請が受理され、承認されれば、日本でもTMBが高い患者のPFSによる申請が可能になると思われます。
なお、CheckMate227の結果は、OSも含めて今年の年末から来年初頭にかけて発表される見込みです。
非小細胞肺がん1次の承認はメルクのキイトルーダに先を越されましたが、BMS=小野薬品工業も承認されれば、メルクに並び、投与人数の大幅な拡大が期待できます。欧米での承認と日本での申請の可否に注目したいと思います。
ただし、日本で申請できなかった場合あるいは承認されなかった場合は、現在進行中で2020年に終了する予定の非小細胞肺がん1次のバックアップ試験の結果を待つ必要があります。
注:
OS(Overall Survival、全生存期間):臨床試験において治療法の割り付け開始日あるいは治療開始日から患者が生存した期間のことを示す。患者が亡くなった原因ががんによるものかどうかに関係なく、統計上は同じ死亡として取り扱われる。
PFS(Progression-Free Survival、無増悪生存期間):治療中(治療後)にがんが進行せず安定した状態である期間のこと。
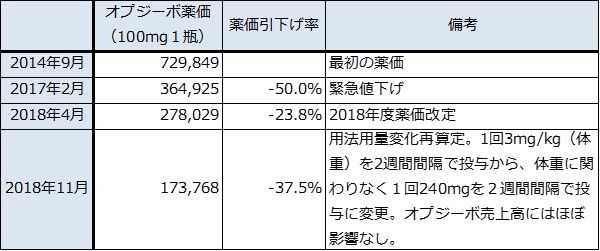
5.オプジーボの薬価は適応拡大に伴って下落へ
オプジーボは、発売当初の薬価が100mg1瓶72万9,849円と高く、1年間の投与金額が約3,200万円しました。この薬価は投与人数の少ない悪性黒色腫を前提に設定されたものですが、非小細胞肺がん2次に適応拡大した後売上高が急増したため、2017年2月に政府の決定で50%の緊急値下げが行われました。
その後は、2018年度薬価改定による薬価引下げがありました。そして、今年11月からは用法用量変化再算定により、100mg1瓶17万3,768円になります。従来は体重1kgにつき1回3mgの投与を2週間間隔で行っていたものを、体重に関係なく1回240mgを2週間間隔で投与する固定用量に変更されたことに伴う薬価改定です。ただし、これはオプジーボの売上高にはほとんど影響しない見込みです。
今回の用法用量変化再算定の前提となっているのは、今年度から導入された市場規模350億円超の薬品について、年4回の新薬収載の機会に薬価改定を行う薬価制度改革です。これによってオプジーボなどの大型医薬品については、適応拡大等による薬価引下げが毎年起こり得ることになります。
なお、2018年4月の薬価改定に続き、2019年10月に消費税増税が実現する場合は、同月に薬価改定が行われる予定です。また、2020年4月にも薬価改定があるはずですが、これはまだ不透明です。加えて、今の方向性なら2021年度(2021年4月)から毎年薬価改定となります。
従って、オプジーボのような高額大型医薬品の場合、常に薬価引下げリスクがあることに留意する必要があります。
表3 オプジーボの薬価
出所:各種資料より楽天証券作成
6.非小細胞肺がんファーストラインの承認期待から投資妙味が期待できよう
オプジーボの年間投与人数は今後の適応拡大と、年間投与人数の20~30%いると推定される長期延命患者の累積により、年を追って増加すると予想されます。当面は、非小細胞肺がん1次の申請、承認が日本で認められるかどうかが最大の焦点となります。その次の焦点は2020年にフェーズⅢが終了する予定の胃がん1次です。
一方で、前述のように適応拡大等に伴う薬価改定が毎年起こる可能性があります。
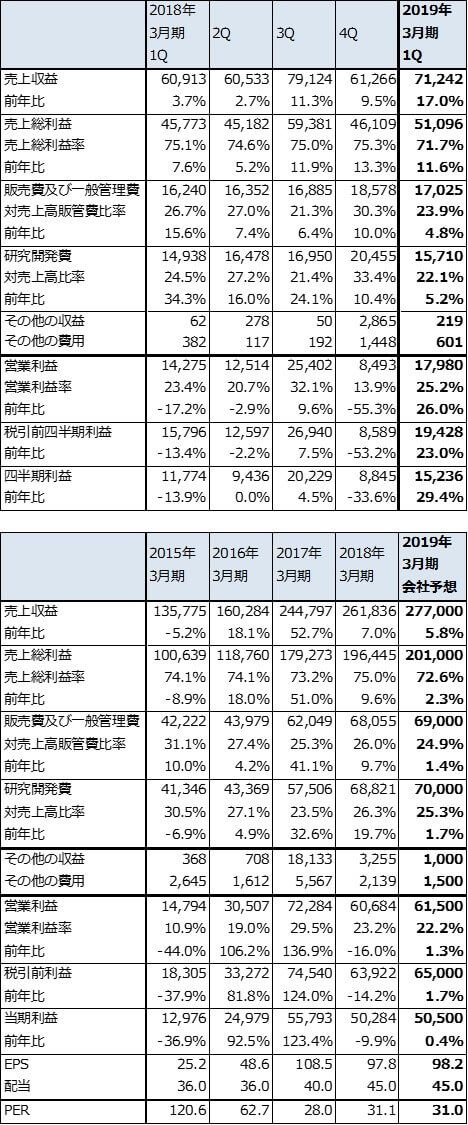
小野薬品工業の業績は堅調と予想されます。BMSが欧米でオプジーボを拡販しているため、BMSからのロイヤルティも伸びています。ただし、適応拡大等に伴う薬価引下げリスクが常にあるため、適応拡大に沿った大幅な業績拡大は考えにくいものがあります。なお、今期のオプジーボ売上高会社予想は前年比横ばいの900億円です。
今回の目標株価は、これらのことを勘案し、6~12カ月の期間で3,600円としました(2019年3月期会社予想EPS98.2円にPER35~40倍を当てはめました)。一定の投資妙味を感じます。
なお、競合品として最も重要なのはメルク(日本ではMSD)のキイトルーダであり、日本では大塚ホールディングス傘下の大鵬薬品工業が共同プロモーションを行っています。次いで、ロシュ=中外製薬のテセントリクですが、まだ規模は小さいです。
ノーベル賞の影響については、がん領域の医師、病院の間ではオプジーボの名前は既に知れ渡っているため、この方面への影響はありません。ただし、小野薬品工業に対する患者やその家族からの問い合わせが多いもようです。オプジーボの投与には病院の規模、体制も含めて様々な条件がありますが、かかりつけの病院がそれらの条件に適合していなかったり、主治医が投与してくれない場合があるもようです。会社側では問い合わせに対して専門医や臨床試験を紹介しています。オプジーボが投与できるにも関わらず漏れている患者がいる可能性があると思われます。
表4 小野薬品工業の業績
発行済み株数 514,121千株
時価総額 1,564,984百万円(2018/10/11)
単位:百万円、円
出所:会社資料より楽天証券作成
注:当期利益は親会社の所有者に帰属する当期利益。小野薬品工業の会計基準はIFRS(国際会計基準)なので用語はIFRSのもの
表5 オプジーボの売上高
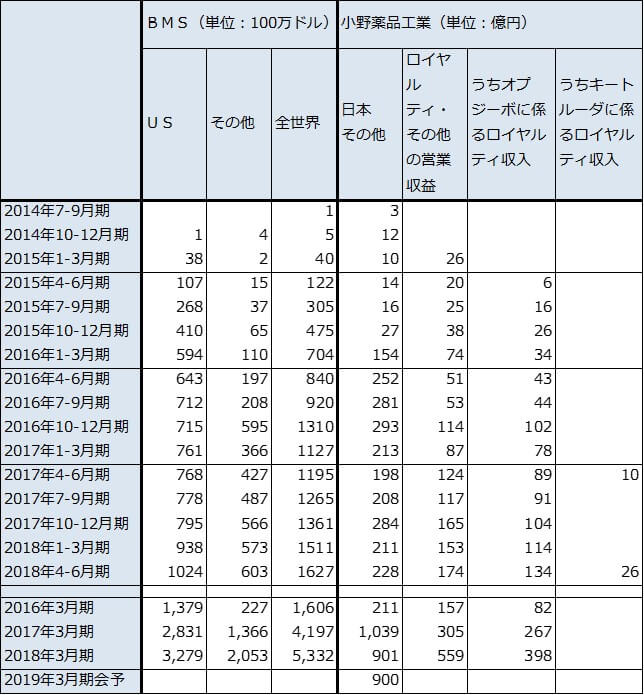
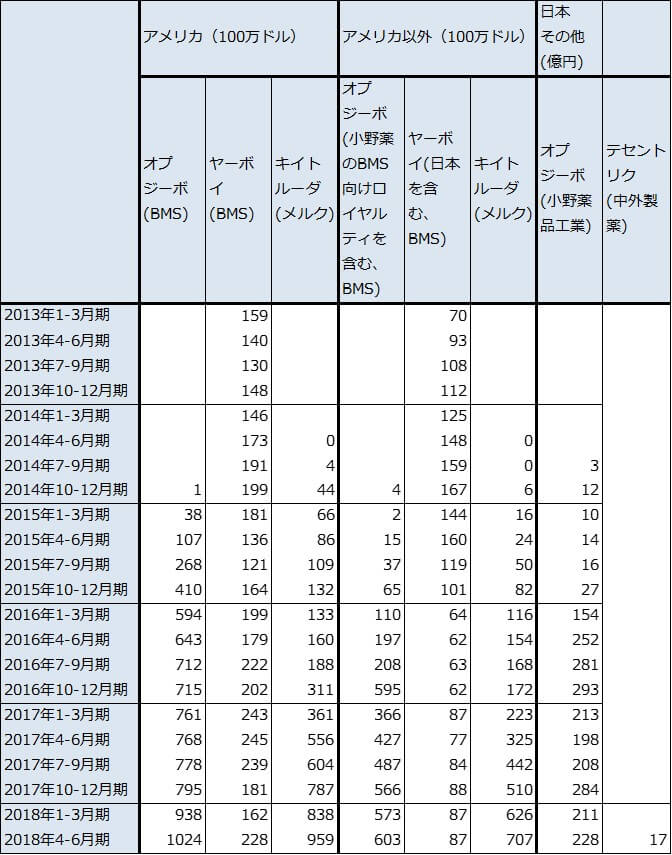
表6 免疫チェックポイント阻害薬の売上高
出所:会社資料より楽天証券作成
注:これ以外にロシュ=中外製薬のテセントリクが2018年1-6月期3億2,000万スイスフラン(全世界、約365億円)になっている
本レポートに掲載した銘柄:小野薬品工業(4528)













![[動画で解説]成長株、割安株、高配当利回り株…どの株を選べばいい?](https://m-rakuten.ismcdn.jp/mwimgs/8/4/498m/img_84b60a4da51373f73b5c52275b097f2837381.jpg)













![[動画で解説]桐谷さんの優待生活に突撃!#1~桐谷さん、おきに優待ベスト3見せてください!~](https://m-rakuten.ismcdn.jp/mwimgs/9/5/498m/img_9528c8c2f23001a3deb43de0c6f7845872398.jpg)




















![[今週の日経平均]最高値更新も「天井サイン」出現!今週の日本株どうなる?!](https://m-rakuten.ismcdn.jp/mwimgs/2/b/160m/img_2b5a074cc6a3e935645125fb974dffcf59165.jpg)


![[動画で解説]みずほ証券コラボ┃7月16日【米株は小型選別 日本株はドル建てに注目~今週は米共和党大会と米決算発表~】みずほウィークリーVIEW 中島三養子](https://m-rakuten.ismcdn.jp/mwimgs/2/a/498m/img_2a5df0131378bd46a83ce1f01fbb418d92438.jpg)
![[動画で解説]【テクニカル分析】今週の日本株 最高値を更新後日本株はどうなる?~出現した「天井サイン」をどう読むか~<チャートで振り返る先週の株式市場と今週の見通し>](https://m-rakuten.ismcdn.jp/mwimgs/6/0/498m/img_60df7a3c9e52ac000de20f75f870968d71371.jpg)
![[動画で解説]円高ショックで日経平均急落、夏枯れ相場始まり?](https://m-rakuten.ismcdn.jp/mwimgs/3/c/498m/img_3c55226b36153bdd05e3d3a674f68f9245072.jpg)
![[動画で解説]新NISAを使った個別株投資について](https://m-rakuten.ismcdn.jp/mwimgs/0/c/498m/img_0c14e3a2b5e84beb52872a9b879aa3e795587.jpg)



















![[今週の日経平均]最高値更新も「天井サイン」出現!今週の日本株どうなる?!](https://m-rakuten.ismcdn.jp/mwimgs/6/c/356m/img_6c199645af38ea98963a94af8b6f3b6934054.jpg)
























![[動画で解説]日銀が7月利上げに踏み切るべきでないこれだけの理由](https://m-rakuten.ismcdn.jp/mwimgs/a/8/160m/img_a8715b638366eed8a8f8d75613b8e92163161.jpg)




