本レポートに掲載した銘柄
サンバイオ(4592)/日東電工(6988)/グリーンペプタイド(4594)/そーせいグループ(4565)
サンバイオ(4592)
1.2017年1月期1Q決算を発表
6月14日、サンバイオは2017年1月期1Q(2016年2~4月期)決算を発表しました。それによれば、表1のように売上高6億2,500万円、営業利益7,700万円と営業黒字となりました(前1Qは営業赤字)。ただし、手持ちの外貨建て現預金に対して為替差損(評価損)3億6,400万円が発生したため、経常損益、当期損益は赤字継続となりました。
2017年1月期通期の会社予想業績は変更されておりません。
表1 サンバイオの業績
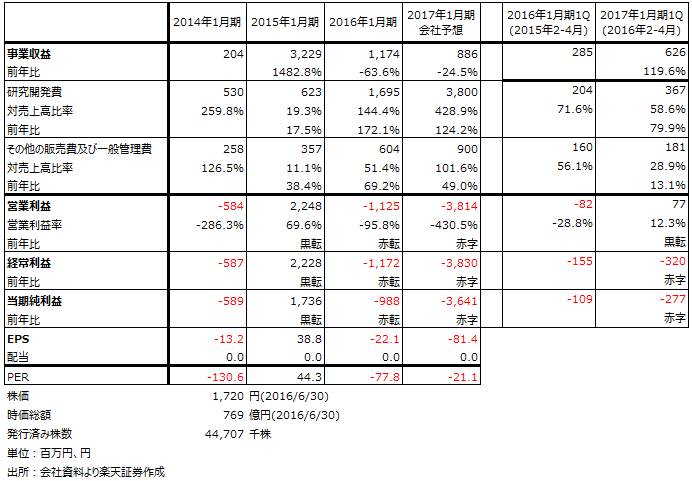
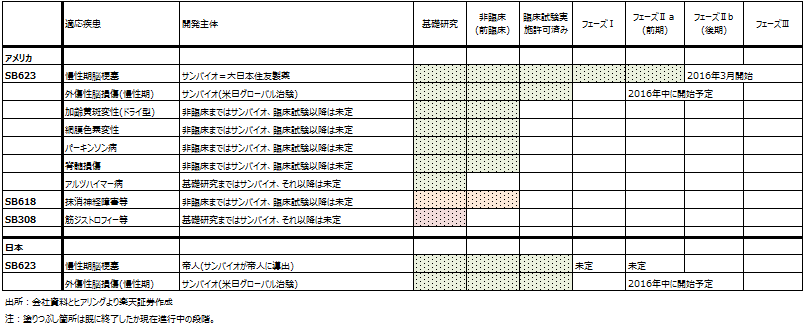
表2 サンバイオの開発パイプライン
2.開発パイプラインの進捗は概ね計画線上と思われる
細胞医薬品「SB623」の臨床試験の進捗状況を以下に示します(概略は表2の通り)。
アメリカでの慢性期脳梗塞向け臨床試験(大日本住友製薬と共同開発中):3月8日にアメリカでフェーズⅡb(被験者156人)の最初の2人に対してSB623の投与が開始されました(フェーズⅡb開始)。これに伴い、4月8日付けで大日本住友製薬から開発マイルストン500万ドル(1ドル=106円換算で約5.3億円)を受領しました。1Qが営業黒字になった理由がこの開発マイルストンです。
この臨床試験フェーズⅡbでは156人の被験者を3グループに分けます。第1グループへはSB623を250万個投与、第2グループへは同500万個投与、第3グループへはプラセボ(偽薬)を投与します。被験者はSB623を1回投与された後、所定のスケジュールに従って定期的にリハビリ訓練を受けながら、最低12~24カ月間の経過観察を受けます。12カ月経過した時点でアメリカFDA(米国食品医薬品局)に経過を報告し、そこで良好な結果が得られたらフェーズⅢの検討に入ると思われます。
被験者募集に関する問い合わせは多い模様ですが、この臨床試験の被験者登録(被験者集め)は、まだ完了していません。フェーズⅠ/Ⅱaは18人の被験者から16人分のデータを得ただけなのに対して、フェーズⅡbは規模が大きく、被験者集めに時間がかかっている模様です。
会社側は今後のスケジュールについてコメントしていませんが、最後の被験者に投与してから12カ月経過後に、データを大日本住友製薬とサンバイオが解析してFDAに報告することになります。被験者登録が完了するのが今から6~12カ月後、データ解析期間を6カ月とすると、FDAへの報告は24~30カ月後、フェーズⅡbが終了してフェーズⅢに移行するのはその後になります。フェーズⅢの開始が2019年中、フェーズⅢが約2年として、臨床試験結果の解析を経て申請→承認→上市となるのは、2021~2022年となる可能性があります。
慢性期脳梗塞について共同開発している大日本住友製薬の2016年3月期決算説明会資料はSB623の承認目標を2020年としていますが、実際に申請→承認→上市となるのは、2021~2022年になる可能性があります。これは日米ともに被験者募集には時間がかかること、アメリカでは通常フェーズⅢを行って申請するためです。もっとも新薬の開発としては、大幅な遅れとまでは言えないと思われます。
また、SB623に由来する副作用は今のところないと会社は考えています。投与する際に頭蓋骨を開いて脳に注射するため、吐き気や頭痛を訴える被験者はフェーズⅠ/Ⅱaの時点でいた模様ですが、一時的なもののようです。
外傷性脳損傷(日米で国際共同治験、サンバイオ単独で実施):外傷性脳損傷では、日米ともにフェーズⅡの治験許可を得ており、2015年10月よりアメリカで被験者の募集を開始しました。これも日米ともに問い合わせが多く、アメリカでは被験者候補が集まり始めていますが、まだ被験者は決まっていません。従って投与は開始されておらず、実質的にフェーズⅡは始まっていません。
この試験では、日米合わせて52名の被験者を集めます。SB623投与後、最低6カ月、最長24カ月のデータを取ります。52名全員の投与が終わって6カ月間のデータをサンバイオが約6カ月かけて解析し、PDMA(医薬品医療機器総合機構)とFDAへ報告することになる模様です。日本ではその後12カ月間で審査が行われ、結果が良好なら条件付承認となる可能性があります(条件付き承認なので、その後一定期間の追跡調査が必要になる)。ただし、この早期承認制度は出来たばかりなので、結論が出るまでの期間については流動的な面があるようです。
従って、1年後までに52人の治験者全員が集まったとすると、流動的ではありますが、日本では早ければ2019年中に申請→承認、2020年に上市となる可能性があります。
また、アメリカの場合は、FDAに試験の解析結果を提出した後、フェーズⅢに入ることになります。フェーズⅢの期間はフェーズⅡの結果次第となります。仮にフェーズⅢが2年必要となれば、2020~2022年に申請→承認→上市となる可能性があります。
日本での慢性期脳梗塞(帝人に導出済み):現時点では帝人が慢性期脳梗塞の臨床試験をいつ開始するか、開始する場合フェーズⅠからなのかⅡからなのか不明です。ただし、サンバイオが単独で行う外傷性脳損傷の治験許可が下りたことから、帝人が臨床試験を始める条件は整ってきたのではないかと思われます。
3.引き続き投資妙味を感じる銘柄
アメリカでの上市時期は、慢性期脳梗塞、外傷性脳損傷ともに2021年以降になりそうですが、日本の外傷性脳損傷は2019~2020年に申請→承認→上市となる可能性があります。実際に日本で販売されるようになれば、SB623の将来性が改めて株式市場で認識されるようになると思われます。長期投資になりますが、脳梗塞の治療薬と言う魅力的な新薬を開発している会社であり、投資妙味を感じます。
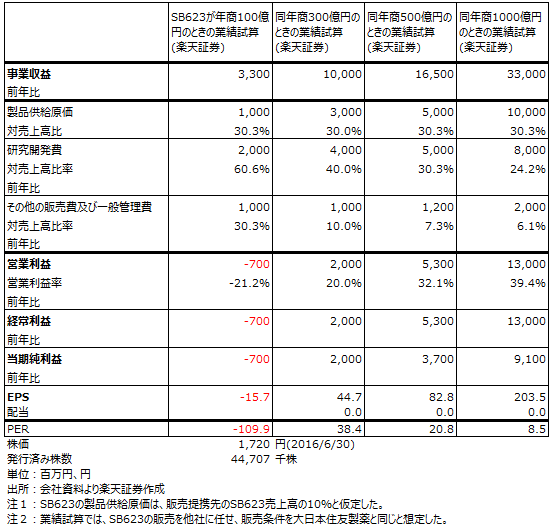
なお、表3は4月15日、4月22日付けの本稿に掲載した当社将来業績の試算です。日本で上市できれば、早い時期に300億円以上の年商(薬価ベース、販売提携先は未定)が実現出来ると思われ、当社はそこから販売ロイヤルティと製品供給フィーを受け取ることになります。SB623が上市されれば、早期の黒字化が可能と思われます。
表3 サンバイオの将来業績試算
日東電工(6988)
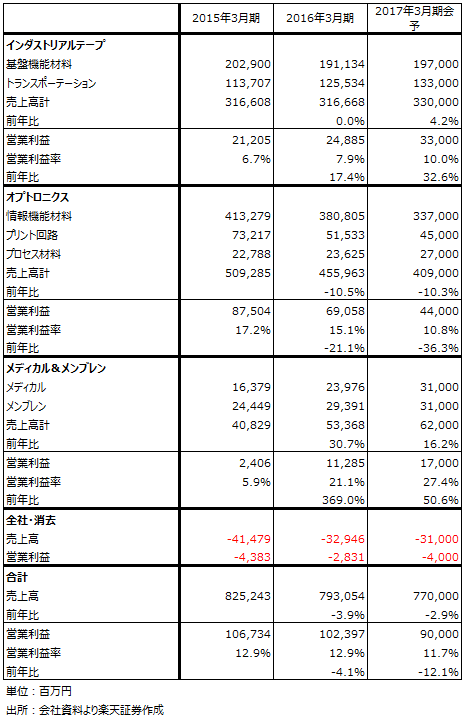
1.液晶用偏光板の世界最大手
日東電工は液晶用材料の世界的大手です。特に重要製品である液晶用偏光板では、日東電工、住友化学、LG化学の3社が世界シェアの80%強を得ていますが、当社はトップシェアです(推定シェア35~40%)。特に高級スマホ向けに強いと言われています。
液晶用材料は、iPhoneを中心とした高級スマホの需要減少によって、昨年末から厳しい市場環境にあります。また、2017年秋発売のiPhoneから有機ELパネルがiPhoneの一部機種に搭載され、2018年秋発売の機種から幅広く搭載されると言われています。液晶用偏光板は、液晶パネル1枚に付き偏光板を2枚使うのに対して、有機ELパネルは1枚になります。このため、日東電工の情報機能材料事業について厳しい将来を予想する向きがあります。
ただし、液晶パネルではタッチパネルがインセル(パネル組み込み)になっているのに対し、有機ELはITOフィルム(静電容量式タッチパネル用)を重ねることが出来ること、スマートフォン向け液晶用偏光板の市場がいきなりなくなるわけではないことから、有機EL用偏光板とITOフィルムでも大手の当社にとっては、液晶向けから有機EL向けの需要シフトはスムーズに進むと見ることも出来ます。当面の業績には注意が必要ですが、2019年3月期頃に端境期を脱する可能性もあると思われます。
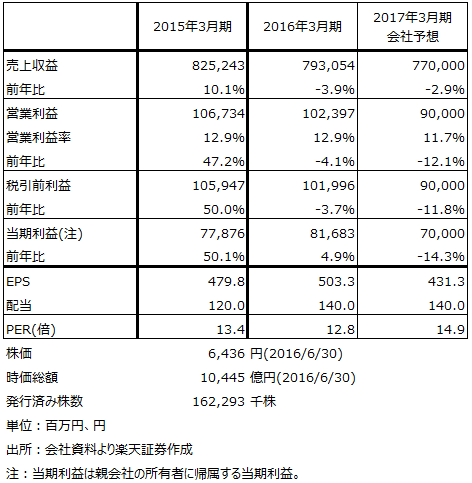
表4 日東電工の業績
2.核酸医薬品の受託生産でも世界最大手
当社は、世界トップクラスの高機能フィルムメーカーであると同時に、核酸医薬品の受託生産でもトップクラスの会社です。抗体医薬品(バイオ医薬品)が、その病気にのみ発現するタンパク質に影響して病気を治すのに対して、核酸医薬品はDNA、RNAに影響を与え、その病気に特定の遺伝子の働きを阻害して病気を治します。核酸医薬品は、低分子医薬品、抗体医薬品に次ぐ第3の医薬品と言われています。
核酸は合成が可能なため、大量生産できます。ただし、核酸は体内に入ると分解され易いため、患部に運ぶために優秀なドラッグデリバリーシステムが必要になります。当社は核酸医薬品のために、高分子合成技術を応用した核酸合成用ビーズを製品化しています。
現在のところ、世界の核酸医薬品の受託生産では当社がトップです(推定シェア50~60%)。顧客は主に欧米と日本の製薬メーカー、バイオベンチャー、大学・研究機関です。表5の「メディカル」の中に核酸医薬品の受託生産、貼り薬、テーピングが含まれています。この分野はまだ当社の中では小さいですが、急成長しています。メンブレン(ろ過膜など)と合わせたメディカル&メンブレン部門の営業利益率は当社のセグメントの中で最も高く、利益も急成長しています。
なお現在、世界市場で上市されている核酸医薬品は、次の3品のみです。
- Vitravene(一般名fomivirsen):サイトメガロウイルス性網膜炎症の治療薬。眼内注射(1998年)。Isis社。
- Kynamro(カイナムロ、一般名Mipomersen):家族性コレステロール血症治療薬で全身に投与(2012年)。Genzyme社。
- Macugen(一般名:Pegaptanib):加齢黄斑変性症の治療薬。眼内注射(2004年)。Eyetech Pharmaceuticals/Pfizer。
表5 日東電工のセグメント別業績
3.肝硬変治療薬を開発中、2020年承認を目指す
当社は、自ら核酸医薬品の開発も行っています。現在、肝硬変治療薬「ND-L02-s0201」を開発中です。2014年からアメリカでフェーズⅠb/Ⅱa試験を開始しましたが、既に終了しており、今秋より2018年までフェーズⅡb、その後フェーズⅢに進み、2020年に承認を受けたいとしています。なお、Ⅰb/Ⅱa試験の中間結果に基づきFDA(米国食品医薬品局)へ申請した結果、NASH(非アルコール性脂肪性肝炎)及びC型肝炎に伴う肝線維症と肝硬変を対象として、2015年11月にファスト・トラック(優先承認審査制度)の指定を受けました。これによって早期承認が可能になります。
日本とブルガリアでも2015年にフェーズⅠb/Ⅱaに進んでいます。次の段階にいつ行くかは不明です。
肝硬変の患者は全世界に約600万人いると言われています。日本でも、推定で40~50万人の患者がおり、その中で毎年約1万7,000人が肝硬変だけで死亡しています。アメリカでも数百万人いると思われます。肝硬変は、C型、B型の肝炎、アルコールの多飲、非アルコール性脂肪性肝炎(NASH)から進行してなります。これらの原因によって肝臓が傷つくときに、それを修復するためにできる「線維(コラーゲン)」というタンパク質が肝臓全体に広がった状態が肝硬変で、肝臓全体が硬く小さくなり、機能が低下します。放置しておくと死亡したり肝臓がんになる恐れのある病気です。
肝硬変になる前段階での治療法(C型、B型肝炎など)はありますが、肝硬変になった後の治療法は限られています。当社の「ND-L02-s0201」は肝硬変に限らず「線維症」を治す薬です。上市されれば、早期に年商1,000億円を超えると思われます。上市する際には、当社は販売委託先を探す意向であり、上市後は販売ロイヤルティを受け取ることになると思われます。
肝硬変治療薬の次は、肺線維症治療薬の臨床試験を来期から始める見込みです(おそらくアメリカから)。他にも複数の前臨床のパイプラインを持っている模様です。
4.業績は当面底を探る動きだが、肝硬変治療薬の将来性に期待したい
2017年3月期業績は、下方修正の可能性があります。会社側の今期前提レートは1ドル=110円で、1ドル1円の円高で20億円のマイナス要因が営業利益に対して発生します。また、液晶向け材料(表5の情報機能材料)と自動車向け(インダストリアルテープの中のトランスポーテーション)にも下方修正の可能性があります。このため、会社予想営業利益は今期900億円ですが、700億円前後になる可能性があります。
また、来期(2018年3月期)、来々期(2019年3月期)は液晶向けが減少して有機EL向けが伸びる、業績の端境期になると思われます。
一方で、メディカル&メンブレン部門の利益寄与は大きくなっていくと思われます。肝硬変治療薬は2020年上市とすると、2022年3月期から業績に本格寄与すると予想されます。仮に薬価ベースで年商1,000億円となれば、販売ロイヤルティを20~30%と仮定すると、営業利益に200~300億円の寄与が発生することになります。当社にとっては大きな寄与です。まだ先のことですが、当社を製薬メーカーとすると、新薬効果を早めに株価に織り込むことになる可能性があります。
このように、業績トレンドと新薬の中身を見ると、中長期投資という前提ですが、投資妙味があると思われます。
グリーンペプタイド(4594)
1.がんペプチドワクチン「ITK-1」「GRN-1201」を開発中
がん免疫療法剤の中でもがんワクチンは、一時期大きな話題になりましたが、今の人気は下火となっています。それは、前評判ほどの効能がなかったためです。途中で臨床試験が中止になった新薬プロジェクトもあります。医師の間でも、がんワクチン、あるいは(免疫チェックポイント阻害剤以外の)がん免疫療法は効かないという評価が一般的になっています。
これに対してグリーンペプタイドのがんペプチドワクチン「ITK-1」は、これまでの臨床試験の結果を見る限り「効く」新薬と評価されます。ITK-1を作るには、まず、「免疫メモリー」のあるペプチドを選びます。免疫系には、過去にそのペプチドを目印にがん細胞を攻撃した記憶が残っている場合があり、この免疫メモリーをがんに対する攻撃に使います。
また、あらかじめ患者をバイオマーカーで検査し、その患者の体内で免疫反応し易いペプチドを4種類選択します。ペプチドは12種類の化学合成ペプチドから選びます。他社のがんワクチンは1種類のT細胞でがんを攻撃するため、がんを攻撃するために免疫を強化しても、反対側でがん免疫逃避機構によって攻撃が無力化される場合が多いのです(がんが自分を攻撃する免疫の働きを止めてしまう仕組みが「がん免疫逃避機構」で、PD-1=PD-L1のような抗体同士のつながりです。この繋がりを絶ってしまうのが、オプジーボのような免疫チェックポイント阻害剤です)。しかし、ITK-1は4種類のT細胞でがんを攻撃するように働きかけるため、攻撃が阻止される可能性が低くなるのです。
このように、テーラーメイド型のがんペプチドワクチンを作るため、他のがんワクチンに比べ手間がかかりますが、比較的効果の高いがん免疫療法剤となるのです。表6はITK-1導出先の富士フイルムの委託を受けて当社が行った臨床試験フェーズⅠの結果です(前立腺がん向け)。従来の抗がん剤に比べて著しく効くわけではありませんが、概ね良好な結果です。
また、重要なことですが、副作用がほとんどありません。現在のところ確認されているのは、投与部位の炎症だけであり、これは多くの抗がん剤で見られる副作用です。免疫チェックポイント阻害剤で見られる自己免疫疾患(免疫が暴走して自分の体を攻撃すること。下痢、肺炎などが起こる)は今のところありません。ペプチドは人体に害がないため、長期投与に向いた抗がん剤と言えます。
表6 グリーンペプタイド:ITK-1の臨床成績(去勢抵抗性前立腺がん)

2.ITK-1は前立腺がん向けに2019年3月期承認を目指す
ITK-1は、富士フイルム(富士フイルムホールディングス子会社)に、全世界向け、全適用について導出しています。上市までの開発マイルストンは合計20億円(今後獲得可能な金額)で、販売ロイヤルティは日本5%、海外5%未満です。適用拡大については別途協議することになります。前立腺がんだけでなく、固形がんであれば効く可能性があります。
ITK-1の前立腺がん向けについては、富士フイルムに導出していますが、同社から委託される形で当社が臨床試験を行っています。そのための開発支援金を得ているため、ITK-1の開発については黒字になっています。
ITK-1の前立腺がん向けは、現在日本ではフェーズⅢで、被験者の症例登録が終わったところです。今後数年間経過観察した後、2018年3月期に申請、2019年3月期承認となりたい意向です。その後の適用拡大については、富士フイルムの意向次第となります。
前立腺がんの国内患者数は、2015年約35万人、2020年予想約40万人で、このうち去勢抵抗性前立腺がん(前立腺がんを進行させる男性ホルモンを薬で抑える治療法がホルモン療法だが、これが効かなくなった状態のがん)の約60%がITK-1の対象患者になります。競合は、2014年に日本で承認されたアステラス製薬の「イクスタンジ」(2016年3月期の日本売上高262億円)と、同年に承認された「ザイティガ」(ヤンセンファーマ)。当社は副作用が少ないことを利点に幅広い患者がカバー出来るとしています。
3.GRN-1201は免疫チェックポイント阻害剤との併用になる見込み
もう一つの開発パイプラインは、「GRN-1201」です。ITK-1と同じ構造のがんペプチドワクチンですが、欧米人に多い白血球のタイプに適合しており、海外向けです。現在メラノーマ向けにアメリカでフェーズⅠを実施しています。2017年6月にフェーズⅠが終了する予定ですが、その後は、フェーズⅡa(フェーズⅡ前期)は当社単独で行い、フェーズⅡb(後期)からは他社への導出を検討しています。
フェーズⅡaから免疫チェックポイント阻害剤との併用試験になる模様です。免疫チェックポイント阻害剤でがんの免疫逃避機構を動かなくして、一方で、GRN-1201で免疫を強化すれば、一層効果的な抗ガン剤になるというアイデアです。このアイデアだけでなく、免疫チェックポイント阻害剤と他の抗がん剤、がん免疫療法剤、他の免疫チェックポイント阻害剤、放射線治療などとの併用試験が、国内外で数多く検討され、実施されています。開発パイプラインの導入を検討する製薬メーカーの間でも人気のあるテーマなので、GRN-1201は好条件での導出の期待が持てます。併用の対象となる免疫チェックポイント阻害剤は現在検討中ですが、小野薬品工業のオプジーボかメルクのキートルーダになると思われます。
臨床試験の期間は、フェーズⅡaが約2年、フェーズⅡbは結果が良好でその後申請できそうなら、3~4年と思われます。この場合、申請→承認→上市は2022年以降になります。時間がかかりますが、それまでに兄弟薬のITK-1が国内で上市していると思われますので、その売れ行き、効き方でGRN-1201の将来もある程度見通せると思われます。
4.当面は赤字が続こう。新株予約権の発行で約45億円を調達する予定。
6月9日付けでメリルリンチ日本証券に対して新株予約権を発行しました。全て行使されれば約45億円を調達出来る予定です。その行使が現在行われています。発行済み株式数は、5月末3,181万株に対して、最大540.8万株増えます(希薄化率は17.0%)。大きな希薄化ですが、全て行使されれば、現預金は資金調達前の約25億円と合わせて約70億円となります。GRN-1201の開発費が年間10数億円かかりますが、今回の資金調達の結果、4年程度は開発費とそれによる赤字に耐えられるようになると思われます。
当面は赤字が続くと思われます。ITK-1は国内向けのみでは大きなロイヤルティ収入は発生しないと思われます。黒字化と利益成長はGRN-1201の完成、上市を待つ必要があります。ただし、ITK-1とGRN-1201は副作用がほとんどなく、面白い特性の抗がん剤なので、注目したいと思います。
表7 グリーンペプタイドの業績
そーせいグループ(4565)
1.開発パイプラインのリストが更新された
6月24日、そーせいグループの株主総会が開催されましたが、そこでの説明資料と、それに先だって更新されたヘプタレスの会社資料に、新たな事項が追加されています。
まず、開発パイプラインの中で、「ウェーブ2」と区分けされた導出前で前臨床までのパイプラインが2本追加になっています。5月20日付けの本稿では導出前パイプラインは7本でしたが、これが今回は9本になっています(表8)。表8で非開示となっている3本のうち2本が追加分と思われます。いずれも希少疾患か患者数が比較的少ない病気の治療薬候補と思われますが、新たな導出候補です。
また、上述のヘプタレス社資料には、導出されたパイプラインの2016~2019年の進捗予想も記載されています。4月の資料では、ムスカリン受容体M1作動薬のフェーズⅡ開始が2017年、M4作動薬のフェーズⅠ開始が2017年の早い時期となっていましたが、これらが表9のように記載されています。M1作動薬は2016~2019年にフェーズⅡが開始して終了、M4作動薬はフェーズⅠが開始して終了、M1/M4デュアル作動薬はフェーズⅠ開始となっています。各臨床試験の開始、終了年は明確でないものの、重要パイプラインの進捗の目安にはなります。
2.次の重要イベントはM1作動薬のフェーズⅡ入りと結果発表、新たな大型導出か
パイプラインの重要度を考えると、そーせいグループの株価にとっての次の重要イベントは、M1作動薬のフェーズⅡ入りと結果の公表(ヘプタレス資料によれば2019年までに予想されます)と、アラガン並みかそれ以上の大型導出の実現ということになると思われます。いずれもしばらく時間がかかると思われます。
株価は大きな調整の後、急速に戻していますが、今後戻りを試す展開も予想されます。ただし、注目度の高い銘柄であり、引き続き株価変動の大きな展開が予想されます。
表8 ヘプタレスの開発パイプライン(2016年6月更新)
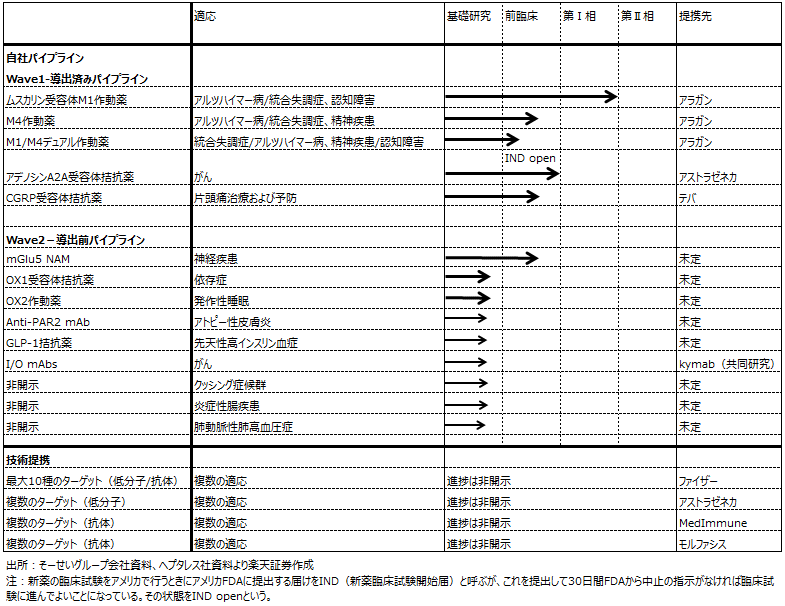
表9 ヘプタレスのパイプライン進捗予定2016-2019

本レポートに掲載した銘柄
サンバイオ(4592)/日東電工(6988)/グリーンペプタイド(4594)/そーせいグループ(4565)
本コンテンツは情報の提供を目的としており、投資その他の行動を勧誘する目的で、作成したものではありません。銘柄の選択、売買価格等の投資の最終決定は、お客様ご自身でご判断いただきますようお願いいたします。本コンテンツの情報は、弊社が信頼できると判断した情報源から入手したものですが、その情報源の確実性を保証したものではありません。本コンテンツの記載内容に関するご質問・ご照会等には一切お答え致しかねますので予めご了承お願い致します。また、本コンテンツの記載内容は、予告なしに変更することがあります。
