本レポートに掲載した銘柄
カルナバイオサイエンス(4572)/タカラバイオ(4974)/ヘリオス(4593)
バイオ株コメント
カルナバイオサイエンス(4572)
米プロナイ・セラピューティクスへ低分子キナーゼ阻害薬 AS‐141を導出
先週の本稿でお伝えしたように、当社は5月27日付けでアメリカのバイオベンチャーであるプロナイ・セラピューティクス(ProNAi Therapeutics, Inc.)へ低分子キナーゼ阻害薬「AS‐141」を導出したと発表しました。AS-141はCDC7/ASK阻害薬と言われ、がん細胞のみを選択的に殺し、副作用の少ない抗がん剤です。現在、前臨床(動物実験)の段階です。
このライセンス契約条件では、プロナイ 社は契約一時金90 万ドル(約1億円)を支払います。また、開発状況、承認、上市などの進捗に応じて最大270 百万ドル(約300 億円)のマイルストンを支払うことになります。上市後の売上高に対しては一ケタの段階的ロイヤリティを支払う契約です。臨床試験入りは2017年下期になる見込みです。
なお、プロナイ社が支払うことになるマイルストンの内訳は非開示となっていますが、フェーズⅠ入りから段階を経るに従い金額が増えると思われます。プロナイ社もカルナバイオと同じバイオベンチャーであり、2015年12月期の売上高はなく、営業赤字約40億円の会社ですが、現金及び現金同等物は1億5,000万ドル(1ドル=109円換算で約164億円)持っています。ただし、新薬の研究開発が先行しているため、最大約300億円の当社への支払い予定マイルストンについては、上市前よりも上市後の販売マイルストンの比重が大きいと思われます。
当社がプロナイ社への導出を決めた背景には、第一に手持ちの開発パイプラインの一部を他の企業へ導出することで収益を安定化させることがあります。ただし、もう一つ重要な目的は、プロナイ社が今後行うAS-141の臨床試験をできるだけ観察したいという考えがあるようです。2015年6月にジョンソン・エンド・ジョンソンの子会社ヤンセン・バイオテックに免疫疾患治療薬(詳細は不明)を導出しましたが、相手が大きすぎて導出したパイプラインがどのように扱われているのか、相手からのレポートがないと分からないようです。
プロナイ社の場合、企業規模がカルナバイオと大きく変わらないことに加え、数々の新薬の臨床試験に携わってきた専門家がいます。これがカルナバイオが同社への導出を決めた大きなポイントだったようです。チーフ・デベロップメント・オフィサーであるバーバラ・クレンク博士は、同社に入る前に「アバスチン」(ジェネンティック(ロシュの子会社で世界的なバイオ企業)が開発し大ヒットした抗がん剤(分子標的薬))をはじめとする重要新薬の臨床試験に携わった経験を持っています。カルナバイオはいずれは自力で臨床試験を行い申請承認まで持って行きたいという意欲を持っていますが、今回の導出はそのための研究と言う色彩もあります。
カルナバイオのパイプラインに注目したい
プロナイ社から見ると、カルナバイオのパイプラインを導入したのは、カルナバイオが「キナーゼ」に特化した比較的珍しいバイオベンチャーであること、プロナイ社同様、がん領域にターゲットを絞った会社だということと思われます(プロナイ社は抗ガン剤の専門ベンチャーです)。
カルナバイオは、昨年に続き今年も累計で2本目の導出を決めました。この背景にはカルナバイオのパイプラインのユニークさがあります。細胞間の情報を伝達する「キナーゼ」をターゲットとした新薬開発に特化していること、特に新型抗がん剤の開発パイプラインを複数持っていることが当社の特徴です。
図1にプロナイ社に導出したAS-141の仕組みを示しました。キナーゼの一種であるCDC7/ASKキナーゼは、がん細胞が自らの遺伝子を複製しようとするときに重要な役割を担っています。カルナバイオのCDC7/ASK阻害薬を投与すると、がん細胞が遺伝子を複製するのを妨げ、がん細胞だけが死にます。健康な細胞には影響が少ないため、副作用が少なく、がんが治る新薬が出来る可能性があります。
次の導出候補が「Wntシグナル阻害剤」です。様々ながんやがん幹細胞でWntシグナル(ウイントシグナル)が活性化されており、TNIKキナーゼがWntシグナルの制御に関わっています。Wntシグナル阻害剤(TNIK阻害剤)を使うと、がんの再発の元になるがん幹細胞を殺すことができ、がんを根治することができます(図2参照)。いわゆる「がん幹細胞性阻害剤」の一種です。
当社が開発中のWntシグナル阻害剤は、NCB-0846とNCB-0594です。NCB-0846はがん幹細胞とがん細胞の両方を殺します。これに対してNCB-0594は選択性が強く、がん幹細胞のみを殺し、がん細胞は殺しません。そのため、がんの根治には別の抗がん剤、免疫チェックポイント阻害剤や分子標的薬を組み合わせる必要がありますが、この組み合わせによって多くのがん種で根治治療を実現することができる可能性があります。
いずれも前臨床で動物実験を行っているところです。より多くのデータを得た後に、おそらく来期以降に導出の機会を探ることになりそうです。
当社の当面の目標は、導出で稼いだ資金と今の手元資金を元に、白血病幹細胞を対象としたキナーゼ阻害剤の臨床試験を自力で行うことです。
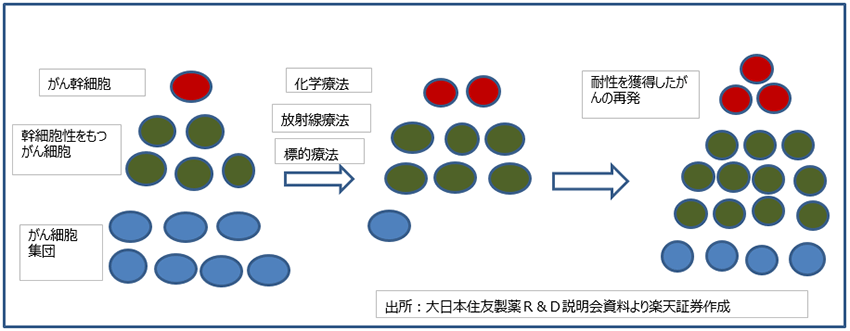
表1 カルナバイオサイエンスの開発パイプライン
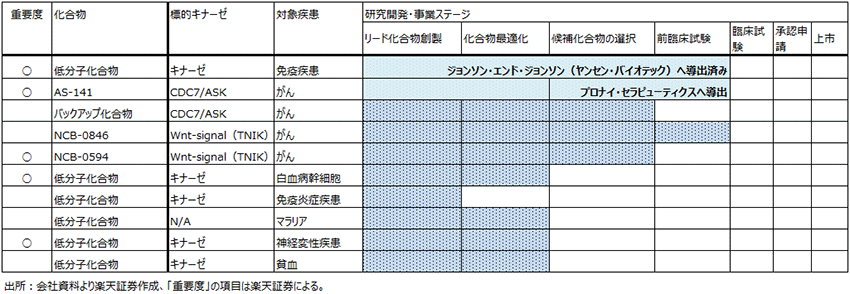
図1 CDC7/ASK阻害薬の働き方
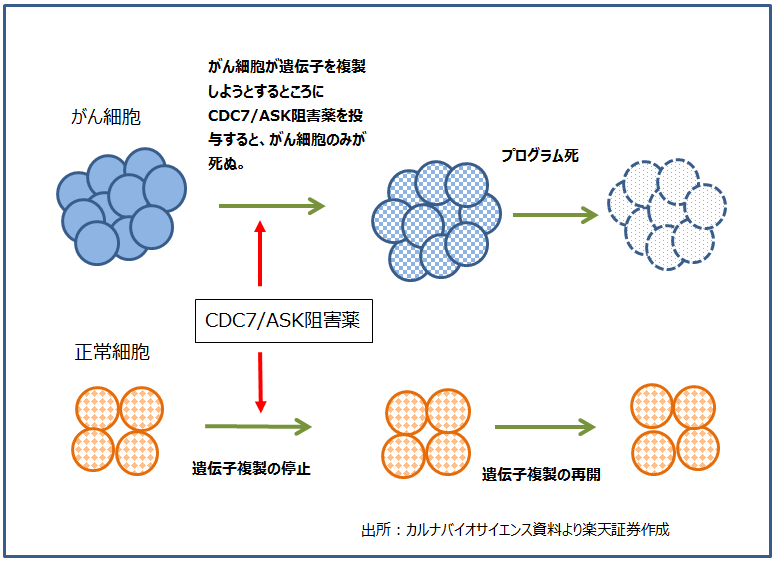
図2 がん幹細胞のメカニズム
今期も黒字の可能性
当社は前期(2015年12月期)に米ヤンセン・バイオテック(J&J子会社)へ新薬候補1種類を導出した結果、黒字となりました。今期はこのヤンセン社に導出したパイプラインが臨床試験入りし、マイルストンが発生する可能性があります。これが実現すると、今回のプロナイ社向け導出を加えて、黒字化できると思われます。ただし、ヤンセン社向けが来期にずれ込む可能性もあります。この場合は、2016年12月期は赤字で2017年12月期の業績が向上することになると思われます。また、来期にプロナイ社が臨床試験入りする予定のため、マイルストン収入が入ると予想されます。来期の黒字化の確度は高いと思われます。
なお、当社は創薬支援事業を持っており、各種の研究用試薬を製造、販売しています。当社でしか出来ないものもある模様で、この事業が安定的に利益を稼いでいます。大口顧客は小野薬品工業ですが、詳細は不明です。
中長期的な投資妙味があると思われます。
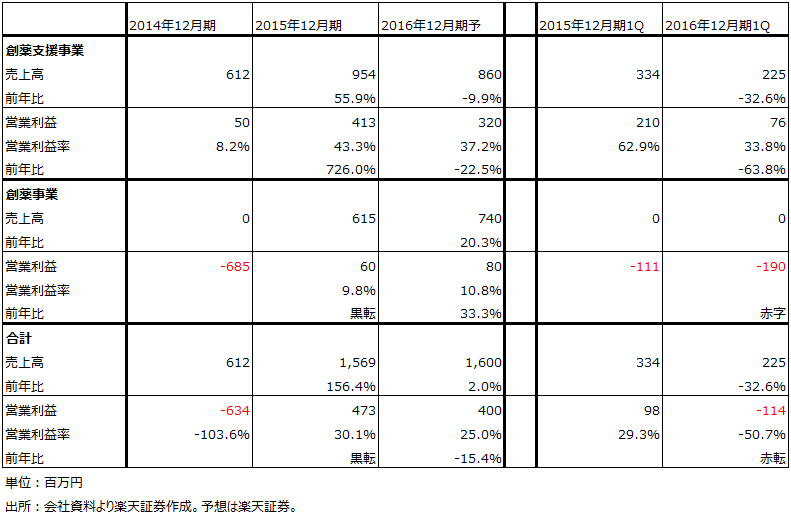
表2 カルナバイオサイエンスの業績
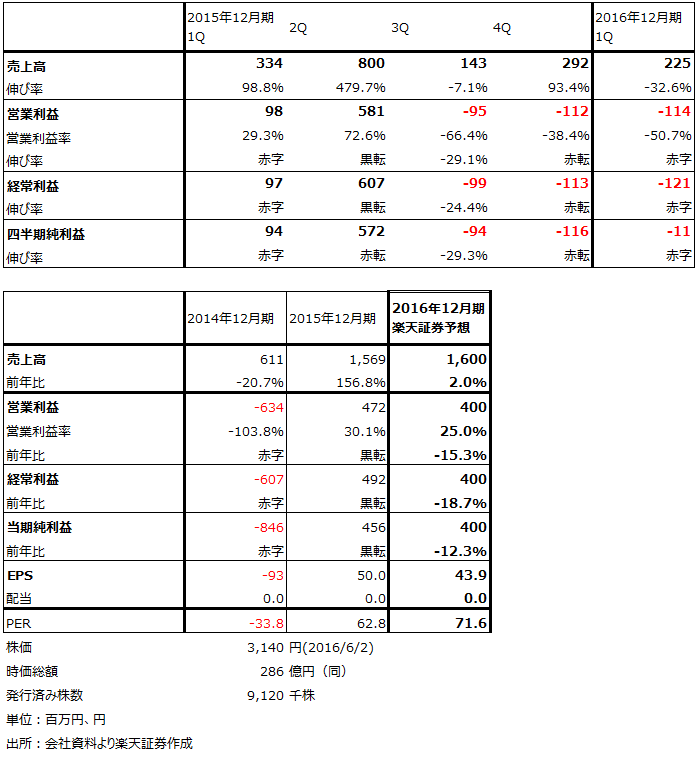
表3 カルナバイオサイエンスのセグメント別業績
タカラバイオ(4974)
バイオセクターの老舗大手
寶酒造は1970年代からバイオ事業に取り組んできた、日本のバイオ産業の草分けの1社です。寶酒造が2002年に宝ホールディングスとなるに伴い、子会社として独立した会社がタカラバイオです。日本のバイオベンチャーとしては大手です。
当社の事業は3つに分かれています。第一が「バイオ産業支援事業」であり、各種の研究用試薬、大学や研究機関などで使う理化学機器、遺伝子治療用ベクター(遺伝子組み換えに用いられる核酸分子)などの製造等を受託する受託サービスから成っています。日本のみならず、アメリカ、欧州、中国、アジアへ世界展開している、この分野では世界的な大手でもあります。研究用試薬の売上高が多いですが、受託サービスでは希少疾患を含む遺伝子治療用ベクターの製造も行っています。その意味で、日本の遺伝子医療の分野でなくてはならない企業と言えます。
バイオ産業支援事業は、営業利益率22.5%(2016年3月期)の高収益事業であり、売上高、利益とも安定成長型の事業です。ここで稼いだ利益を後述の遺伝子医療事業につぎ込むという構図です。また、医食品バイオ事業として健康食品やキノコ事業を行っています。
表4 タカラバイオの業績
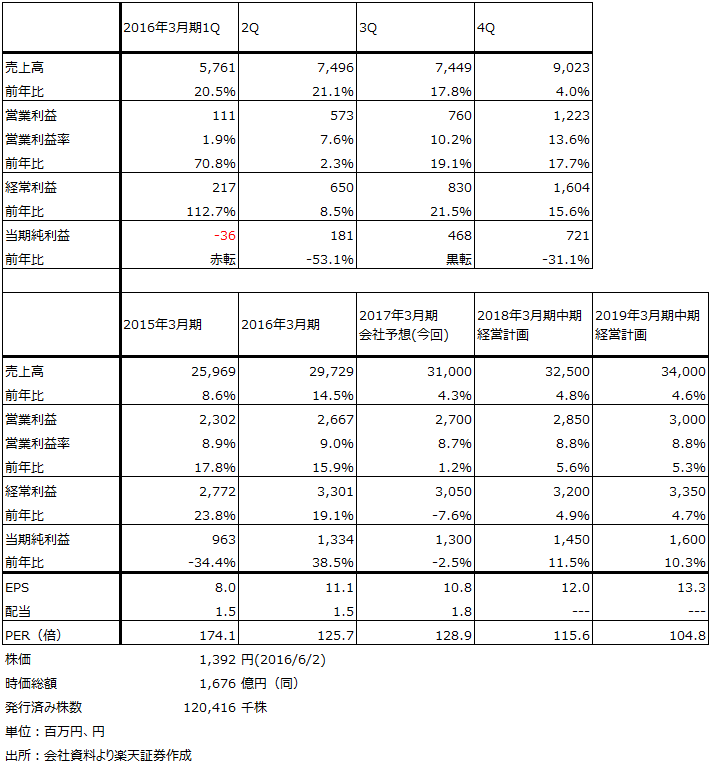
表5 タカラバイオ:セグメント別損益
腫瘍溶解性ウイルス「HF10」
遺伝子医療事業の売上高は現在ゼロであり、今期は約20億円の営業赤字の見込みです。現在いくつかの創薬プロジェクトが進行中ですが、その中で重要なのが、腫瘍溶解性ウイルス「HF10」の開発プロジェクトです。
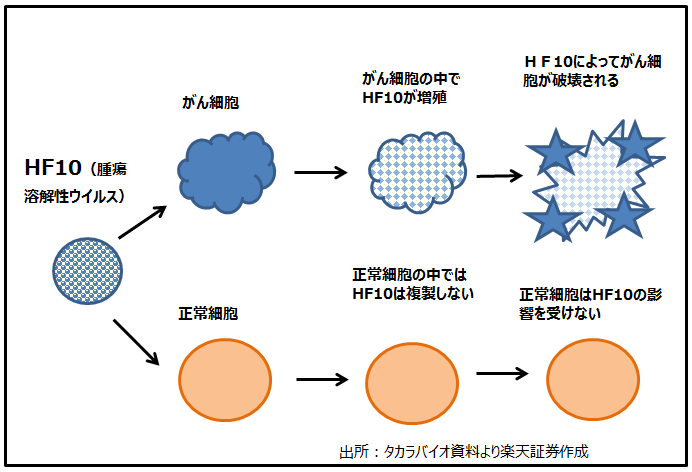
HF10の作用機序を図3に示します。HF10はがん細胞のみをターゲットとしてその中に入り込み、増殖して遂にはがん細胞を破壊します。一方で、正常細胞の中に入っても増殖しないため、正常細胞は影響されません。
HF10の開発は日米で進行中です。まず、アメリカではメラノーマ(悪性黒色腫、皮膚がん)を対象とした臨床試験フェーズⅡが進行中です。46例(患者数)に投与を完了していますが、特徴は免疫チェックポイント阻害剤「イピリムマブ」(商品名「ヤーボイ」、ブリストル・マイヤーズ スクイブ(BMS))との併用療法であることです。決算説明会での会社側の説明では、これまでの結果は良好で、投与から12週目でがんが完全消失した例、24週目でがんが転移した5か所全てが消失した例、48週目で9か所中6か所が消失した例、64週目で8か所全てが消失した例がありました。会社側では今期中にフェーズⅡを終了する予定で、現在フェーズⅢを計画中です。フェーズⅢは2~3年かかると思われるため、その後申請、承認、上市と進むことになります。
日本では、メラノーマを対象としたフェーズⅠが進行中です。これが今期中に終了する予定で、早ければ今年中にフェーズⅡに入りたい意向です。フェーズⅡではアメリカでのフェーズⅡと同様、免疫チェックポイント阻害剤との併用試験になります。現在利用できる免疫チェックポイント阻害剤としては、小野薬品工業の「オプジーボ」(一般名「ニボルマブ」)、BMSの「ヤーボイ」の2種類になると思われますが、どちらになるかわかりません。日本ではフェーズⅡのみで申請出来ますので、2019年3月期には承認を得たいようです。
日本では、すい臓を対象にしたプロジェクトもあります。現在は名古屋大学で研究中ですが、今期中にフェーズⅠ/Ⅱ試験に入りたいとしています。これは、すい臓がんの標準治療薬であるゲムシタビン(商品名「ジェムザール」、イーライリリー)との併用試験となります。約3年かかる見込みです。
HF10と免疫チェックポイント阻害剤などの他の抗がん剤との併用療法の将来には大きな期待が持てます。全部とは行かないと思われますが、相当数のがんが消失する可能性があります。また、HF10は理論上は固形がんであればどのがんに対しても効く可能性があります。即ち、日本で患者が多い肺がん、胃がんなどにも効く可能性があります。すい臓がんの臨床試験が終わった後になると思われますが、他のがん種でも臨床試験を行うのかどうか注目したいと思います。
図3 HF10の作用機序(働き方)
HF10はタカラバイオの成長ドライバーになる可能性が大きい
HF10の上市時期は、日本のメラノーマ向けが2020年3月期、すい臓がん向けが2021年3月期、アメリカのメラノーマ向けが2021年3月期頃になると思われます。各がん種の年間死亡者数は、日本のメラノーマが691人(2012年WHO)、すい臓がんが31,716人(2014年がん情報センター)、アメリカのメラノーマが10,224人(2012年WHO)です。
競合薬はアムジェンのTVECで、単剤での使用で1年間の治療費が約700万円となっています。HF10のほうが副作用が少ないですが、上市後同じ値段になると仮定し、初期の投与人数を年間3,000人とすると、薬価ベースで年商210億円となります。タカラバイオは販売権を他企業に供与する方針なので、販売ロイヤルティを15%とすると、タカラバイオのロイヤルティ収入は約32億円となり、遺伝子医療部門は黒字転換することになります。その後は投与人数の増加と適用がん種の拡大によりますが、今後の臨床試験によって、がんの消失がどの程度の比率で起こるのかが最も重要なデータになります。
このように、今後の臨床試験の結果に注意する必要はありますが、HF10は有望な新薬です。中長期の投資妙味がある銘柄と思われます。
ヘリオス(4593)
iPS関連のバイオベンチャー、加齢黄斑変性治療薬の開発が進行中
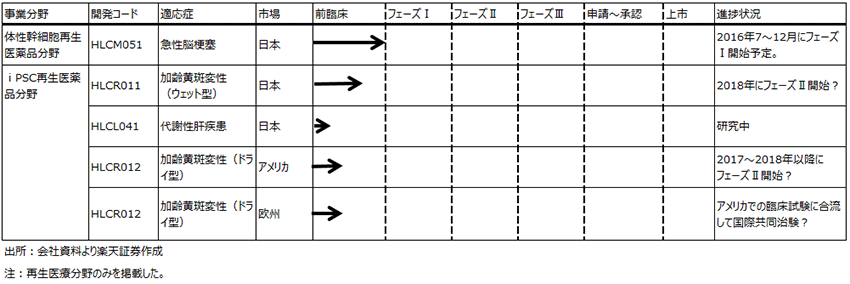
ヘリオスは再生医療を手掛けるバイオベンチャーで、特にiPS関連の再生医療を研究しています。開発パイプラインは表6です。これを見るとわかるように、自社で研究開発しているiPS関連の開発プロジェクトはまだ前臨床段階であり、臨床試験に進むのは時間がかかりそうです。
まず、HLCR011。日本人に多い加齢黄斑変性(ウェット型)の治療薬です。iPS細胞から作られた目の網膜皮質上皮細胞を眼球に移植(注射)して治療します。治療は1~3回程度で済む見込みで、現在の主な治療法である抗VEGF薬(「マクジェン」(ファイザー)、「ルセンティス」(ノバルティスファーマ))の眼球への注射に比べて治療の頻度が少なく再発の可能性が少ない治療法になります。
加齢黄斑変性は視界の中心部が歪んで見えるようになり、失明することもある病気です。患者数は、日本ではウェット型中心に923万人、アメリカ、欧州ではドライ型中心に各々1,000万人、1,300万人です(ヘリオス説明会資料による)。このうち、日本では重度のウェット型患者が63万人、アメリカでは重度のドライ型患者が85~90万人、欧州では同じく110~117万人いると推定されます。現在の抗VEGF薬の年間治療代は約100万円ですので、表6にあるHLCR011(日本での加齢黄斑変性ウェット型向け)、HLCR012(アメリカ、欧州での加齢黄斑変性ドライ型向け、HLCR011と同じ薬品になる)が上市されれば、年間10万人以上が年間治療費100万円で使うと年間1,000億円以上の市場になる計算です。治療効果が高い場合は、100万円よりも価格が高くなる可能性もあります。このように、当社の加齢黄斑変性治療薬は将来性の大きいものです。
ただし、iPS細胞の実用化に対して、慎重な意見もあります。マウスでの実験でiPS細胞が癌化する症例が出ています。当社は、まず日本でHLCR011の臨床試験フェーズⅡを2017年に開始する計画でしたが、現在は2017年以降に、おそらくは2018年に遅れることになりそうです。アメリカ、欧州はグローバル治験として一緒に行うと思われますが、日本での臨床試験が始まってからになる見込みです。
このように当社の自社開発のiPS関連治療薬は、実現するのが2020年以降になりそうです。なお、HLCR011は大日本住友製薬との共同開発となり、開発費のうち68億円を同社が負担することになっています。製造とマーケティングはヘリオスと大日本住友製薬の合弁会社サイレジェンが行いますが、販売はヘリオスが行う予定です。欧米での開発体制やパートナーは未定です。
表6 ヘリオスの開発パイプライン
急性脳梗塞治療薬の臨床試験を今年中に開始する計画
ヘリオスは今期(2016年12月期)に入って開発パイプラインを増やしました。今年1月に、アメリカのバイオベンチャー「Athersys」(アサーシス社)との間で、次の2つの契約を結びました。
- アサーシス社が持つ幹細胞製品MultiStem(マルチステム)を用いた脳梗塞に関する再生医療等製品の開発・販売に関する国内の独占的なライセンス
- 幹細胞製品MultiStemの主成分を、ヘリオスが横浜市立大学と共同研究している肝疾患領域を対象とした再生医療等製品(3次元臓器)の原料として研究・開発するライセンス契約
このうち②については、臨床試験入りはまだ先ですが、①については、今年後半(7~12月)に始まる臨床試験に関わるものです。当社は、急性脳梗塞を対象としたマルチステムの臨床試験フェーズⅡ/Ⅲを今下期に開始する計画です。アサーシス社がアメリカで同じ目的の臨床試験のフェーズⅡに入っているため、日本ではフェーズⅡから開始します。フェーズⅡの結果が良好なら早期承認を狙う目論見です。フェーズⅡに1年半から2年程度かかると思われますので、結果が良好なら2~3年後の2018年12月期か2019年12月期に申請→承認→上市が可能になると思われます。開発(臨床試験)はヘリオス単独で行いますが、販売は他社に販売権を供与することなどを検討中です。
急性脳梗塞の治療では、発症後の早期治療が決め手となりますが、これまでの早期治療では、血栓溶解剤は発症後4時間以内、機械的血栓回収療法は7~8時間以内に治療する必要があり、治療が間に合わない場合がありました。それに対してマルチステムは、発症後18~36時間の患者が対象です。マルチステムは冷凍保存出来るので、病院で保管して患者に投与します。日本では脳梗塞の年間発症患者数は23~33万人、このうち36時間以内に病院に来る患者は6.2万人なので、これが直接のターゲットになります(数字はヘリオス会社資料による)。
ただし、マルチステムには問題もあります。この薬は根治療法ではなく、脳内血管の閉塞による脳組織の壊死(1次損傷)を防いだり治すものではありません。脳梗塞発症後、免疫反応が活発になって脳内に2次損傷が起こることを防ぐための薬です。従って効果には限界があり、患者の全てに有効なわけではありません。
マルチステムはライセンス導入した薬品ですから、臨床試験の進捗に従って支払う開発マイルストン、上市後の販売ロイヤルティが発生すると思われます(詳細は非開示)。契約一時金18億円が計上された結果、当社の今1Qは21億円の営業赤字となりました。今後上市まで、一時金ほど大きくはありませんが、開発マイルストンが発生する期があると思われます。上市後予想される売上高(薬価ベースの売上高)は薬価次第ですが、年間数10億円と思われます。当社には、そこからロイヤルティ―収入が見込めます。2019年12月期にも赤字縮小要因が発生すると思われます。
iPS関連では重要な投資先と思われるが、臨床試験の進展に注意したい
ヘリオスにとって重要なのは、ライセンス品とは言え、2018年12月期か2019年12月期から収益寄与が見込まれるマルチステムの臨床試験が始まろうとしていることです。これまで目玉だった日本での加齢黄斑変性(ウェット型)の臨床試験入りが遅れていることはネガティブな要因ですが、2~3年後に売上高が期待できる新薬プロジェクトが出来たことはポジティブな要因です。今後は加齢黄斑変性(ウェット型)の臨床試験入りがいつになりそうなのか、慎重に見極めたいと思います。この臨床試験が始まって上市が見えてくると、収益寄与が大きくなるため、株価へもポジティブな影響が予想されます。
赤字企業ですので業績への注意は必要ですが、中長期で投資を考えてみたい銘柄です。
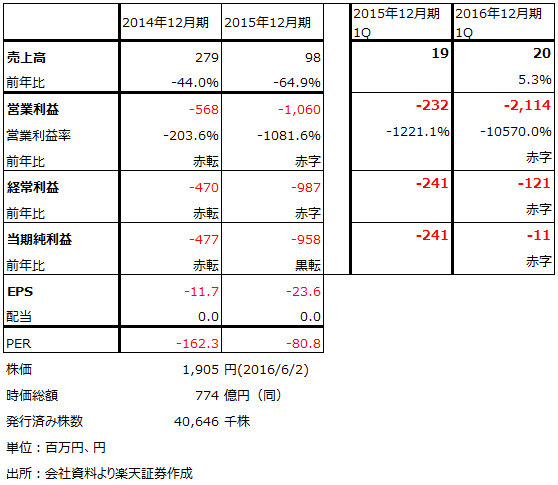
表7 ヘリオスの業績
本レポートに掲載した銘柄
カルナバイオサイエンス(4572)/タカラバイオ(4974)/ヘリオス(4593)
本コンテンツは情報の提供を目的としており、投資その他の行動を勧誘する目的で、作成したものではありません。銘柄の選択、売買価格等の投資の最終決定は、お客様ご自身でご判断いただきますようお願いいたします。本コンテンツの情報は、弊社が信頼できると判断した情報源から入手したものですが、その情報源の確実性を保証したものではありません。本コンテンツの記載内容に関するご質問・ご照会等には一切お答え致しかねますので予めご了承お願い致します。また、本コンテンツの記載内容は、予告なしに変更することがあります。
