本サイトはIR広告であり、Heartseed株式会社から提供を受けた資料をもとに掲載しておりますが、本広告を以って楽天証券が特定の銘柄の売買を推奨するものではありません。 掲載内容は、今後、告知なく変更される可能性があり、また最新の情報でない可能性があります。IRに関する最新情報は、企業のホームページをご確認ください。
 |
銘柄名 | Heartseed |
| 銘柄コード | 219A | |
| 上場市場 | 東証グロース |
IR広告Heartseed(株)会社紹介

当社の心筋再生医療は、これまでの細胞治療とは一線を画す、弱まった心臓を再生心筋で置き換える、「Remuscularization(心筋補填療法)」と呼ばれるもので、当社はこの実現のために独創性のある技術とサイエンスを追求してまいりました。一日も早く患者さんに当社の心筋再生医療を届けられるように研究開発・臨床開発に取り組むと共に、最終的なゴールとして「再生医療で世界を変える」ことを目指して当社の経営を進めてまいります。
事業の内容
当社はiPS細胞由来の心筋細胞の微小組織(心筋球)を心臓に移植する治療法である「心筋再生医療」を確立し、重症心不全患者さんに貢献することを目的として事業活動を行っております。なお、当社の事業セグメントは、医薬品事業の単一セグメントであるため、セグメント情報の記載を省略しております。
当社が日本で開発中の治療法は「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」における再生医療等製品に該当し、日本政府は再生医療等製品の開発・承認期間の大幅な短縮を可能にした法律を世界に先駆けて制定するなど、実用化に向け国を挙げて全面的に後押しをしています。当社は、重症心不全を対象としたリードパイプラインにおいて世界初の心筋再生医療を実現すべく、本制度を活用した条件及び期限付承認を取得することを目指して開発を進めております。現在進行中の治験(後述)は、独立行政法人医薬品医療機器総合機構(PMDA)ウェブサイト上にて、国内開発の最終段階である治験で終了後承認申請が見込まれる治験(「主たる治験」)として届け出ております。
薬事承認後に、iPS細胞由来の心筋再生医療を国内に導入し、続いて事業パートナーであるグローバル大手製薬企業のノボノルディスク エー・エスと共にグローバル市場への展開に取り組んでいく方針です。
心不全とは
心臓の収縮能力や拡張能力が低下するなどの原因により、心拍出量が低下し、それを補うべく、心臓自身が拡大化(悪化)した結果、臓器うっ血や呼吸困難、運動能力の低下をきたす症候群が、心不全です。様々な心臓疾患の病状の進行により起こる終末像とも言え、心不全を引き起こす代表的な原因として、虚血性心疾患(心筋梗塞など)、高血圧、心臓弁膜症、心筋炎、不整脈等心臓や循環器に起因するものに加えて、糖尿病や肺気腫などの他臓器に関連するもの、心臓が生まれつき正常でない先天性心疾患など数多くの病態が存在します。急性期のショックと、慢性的な病態進行が混ざりながら病態が悪化していきます。心不全では、上記の自覚症状が慢性的に継続しながら病態が進行していった結果、最悪の場合は死に至る可能性もあります。
世界保健機関(WHO,Fact Sheets,2021年6月)によると、心不全を含む循環器系疾患は世界の死因の第一位で、2019年には約1,800万人が命を落としています。中でも心不全は生存率が低い疾患で、患者数も増加を続けており、画期的な治療方法の開発が強く望まれています。心不全患者数は2017年時点で世界に約6,500万人とされています(N.L. Bragazzi et al., ESC European Journal of Preventive Cardiology 2020)。この患者数は、高齢者の増加と医療技術の高度化により一命をとりとめるケースが増えたことが一因で、増加することが予想されており、入院患者数や医療費の増大から「心不全パンデミック」と呼ばれるほどに、大きな社会問題となっています。
また、心不全による死亡者数は、米国では2004年に28万人以上で、肺がん、乳がん、前立腺がん、HIV/AIDSを合わせたものよりも多くなっています(Adler, Circulation 2009)。日本でも2020年には、悪性新生物(がん)のうち死亡数の最も多い肺がんより多い約9万人が心不全で亡くなっています。
iPS細胞を用いた心筋再生医療は、心臓移植・補助人工心臓よりも多くの患者さんへの適用を目指すことができます。すなわち、心臓移植を待つ厳しい病態の患者さんへの適用のみならず、病態の早期段階での治療の選択肢としても、心機能の改善、悪化の阻止、病状進行を遅らせるなどの期待があります。多くの患者さんに適用可能になることが望まれております。
当社技術の開発経緯と心臓領域におけるイノベーションの方向性
当社の代表取締役社長である福田惠一は、1999年に骨髄間葉系幹細胞から心筋細胞の分化誘導に世界で初めて成功して以降、世界の再生心筋領域を長らくリードしてきました。くわえて、心臓領域の様々な新薬治験に約30年にわたって携わり、心臓領域の治療法が全身性の標準療法から心筋自体に局所的に作用する医薬品に進化していくであろうイノベーションの方向性を経験しております。その中で福田は、心筋細胞を患者の心臓に移植をして心機能の改善効果を得ようとする、さらに先進的な治療法の実現を一貫して目指し研究成果を積み上げて参りました。
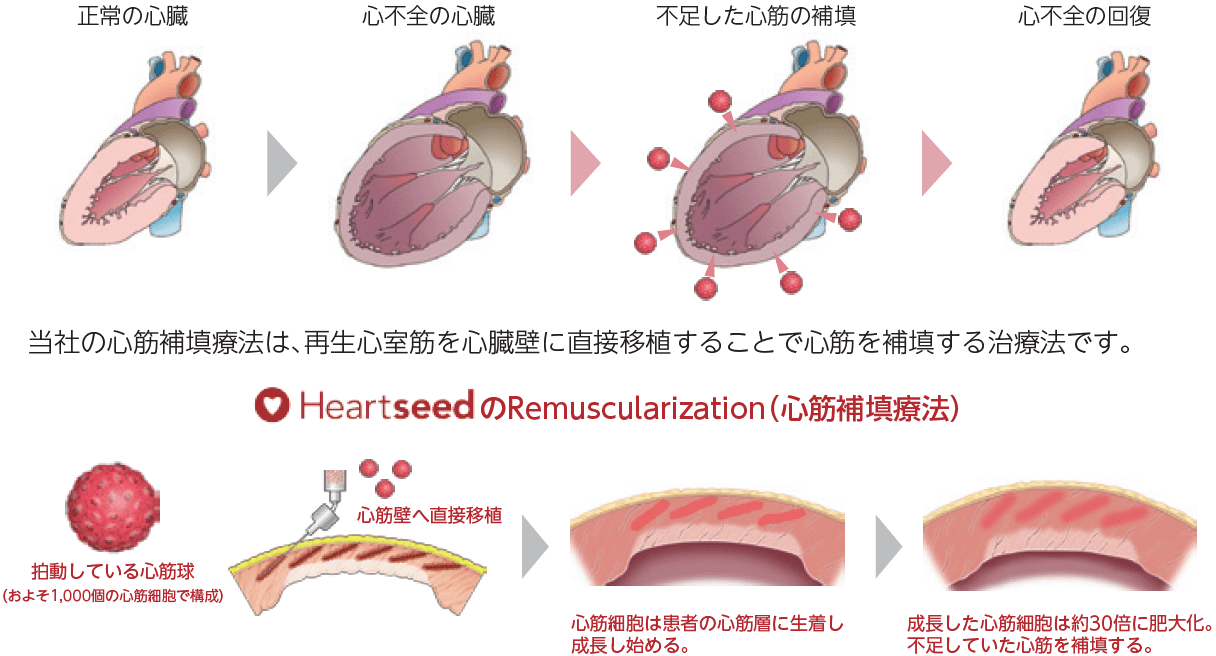
心筋補填療法:不足した心筋細胞を補い心不全の根治を目指す治療法
心筋細胞は生まれた後は細胞分裂をしない為、心筋梗塞等で一部が壊死してしまうと、その後再生することがありません。根治には、残存心筋のパフォーマンスを改善させるだけでなく、根本的な原因である減少した細胞量を補うことで、ポンプ機能を改善させ、拡大した心臓を縮小させることが必要になります。
臨床開発パイプライン
当社は、重症心不全の中でも特に収縮不全の重症心不全を対象に、他家iPS細胞由来心筋球による治療法の開発を進めております。
心筋再生医療を普及させ、世界中の患者さんにお届けするためには、移植方法と免疫拒絶の抑制の2つの側面からパイプラインを展開する必要があると考えております。そのために、当社では、最も確実な開胸手術下で移植するHS-001の治験を先行させ、より負担の少ないカテーテルで移植するHS-005、更に免疫拒絶の起きない自家iPS細胞を用いたHS-040へ展開していく予定です。
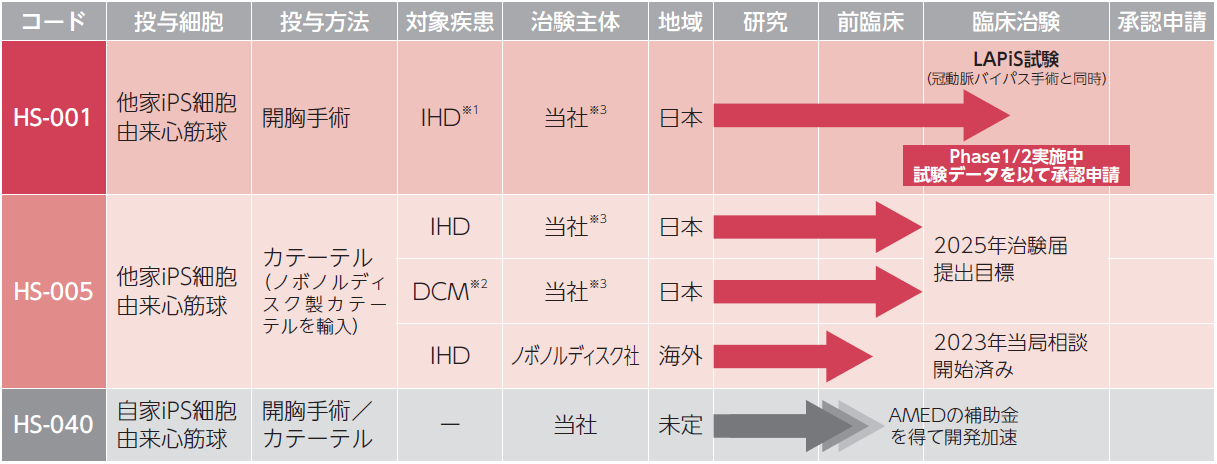
※1:虚血性心疾患を原疾患とする心不全 ※2:拡張型心筋症を原疾患とする心不全 ※3:当社及びノボノルディスク社にて50:50のプロフィットシェア
LAPiS試験概要とMoA※1を証明する評価項目の設定
第I/II相治験「LAPiS試験」において2024年5月末時点で5例の患者さんに投与しております。
虚血性心疾患を原疾患とする重症心不全の患者さんを対象として、冠動脈バイパス手術(CABG※2)時に投与低用量5例、高用量5例の計10例を組み込む治験デザイン

主要評価項目である26週の安全性にくわえ、治験後承認申請の為に、副次評価項目にて複数の評価指標を設定しています。重症患者において、心不全内服薬ではみられない心筋移植部位局所の構造的・機能的な変化を観察し、MoAの証明を伴う心臓全体の機能改善を評価しています。
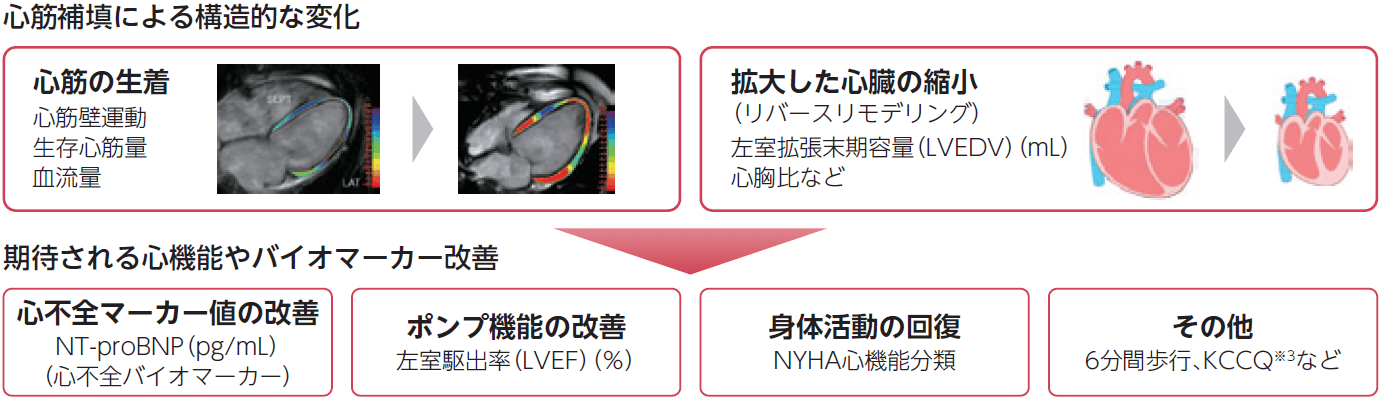
※1 MoA:Mechanism of Action(効果を発揮するための特異的な生化学的相互作用)
※2 Coronary Artery Bypass Grafting
※3 The Kansas City Cardiomyopathy Questionnaire
世界で初めてヒト臨床治験において移植心筋の生着を確認(治験2例目の施設データ)
PET※画像診断を用いて、術前には心筋の生存が見られなかった部位において、心筋球移植後に心筋の生存が確認されました。これはCABGでは起きえない変化であり、移植心筋の生着が示唆されました。

出所:第88回日本循環器学会学術集会(2024年3月8日)での治験施設からの発表データ
※:Positron Emission Tomography
心筋球生着による心臓の構造的変化を確認(治験3例目の施設データ)
MRIストレイン解析を用いて、拡大した心臓の縮小にくわえ、ポンプ機能の改善が確認されました。術後6ヶ月において、心筋球移植部位周辺における「強い収縮」を示す赤い表示が確認できます。
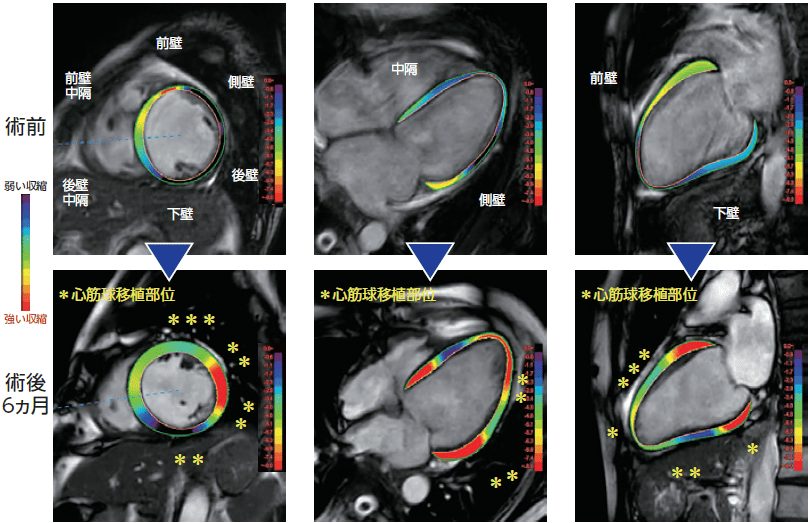
出所:第88回日本循環器学会学術集会(2024年3月8日)での治験施設からの発表データ
移植部位における収縮力の改善を確認
部位毎の収縮力の改善有無を心エコー検査(長軸方向ストレイン)で確認したところ、再生心筋細胞を移植した部位において、70%以上の確率で収縮力の改善が確認されました。

LAPiS試験初期結果に関する学会発表
第88回日本循環器学会において、治験施設より良好な術後1年の結果が発表されました。移植していない部位の悪化の影響を受けた2例目を除き、低用量の心筋球移植であるにもかかわらず、LVEDVやNT-proBNPなどの客観的指標において著しい改善が認められました。
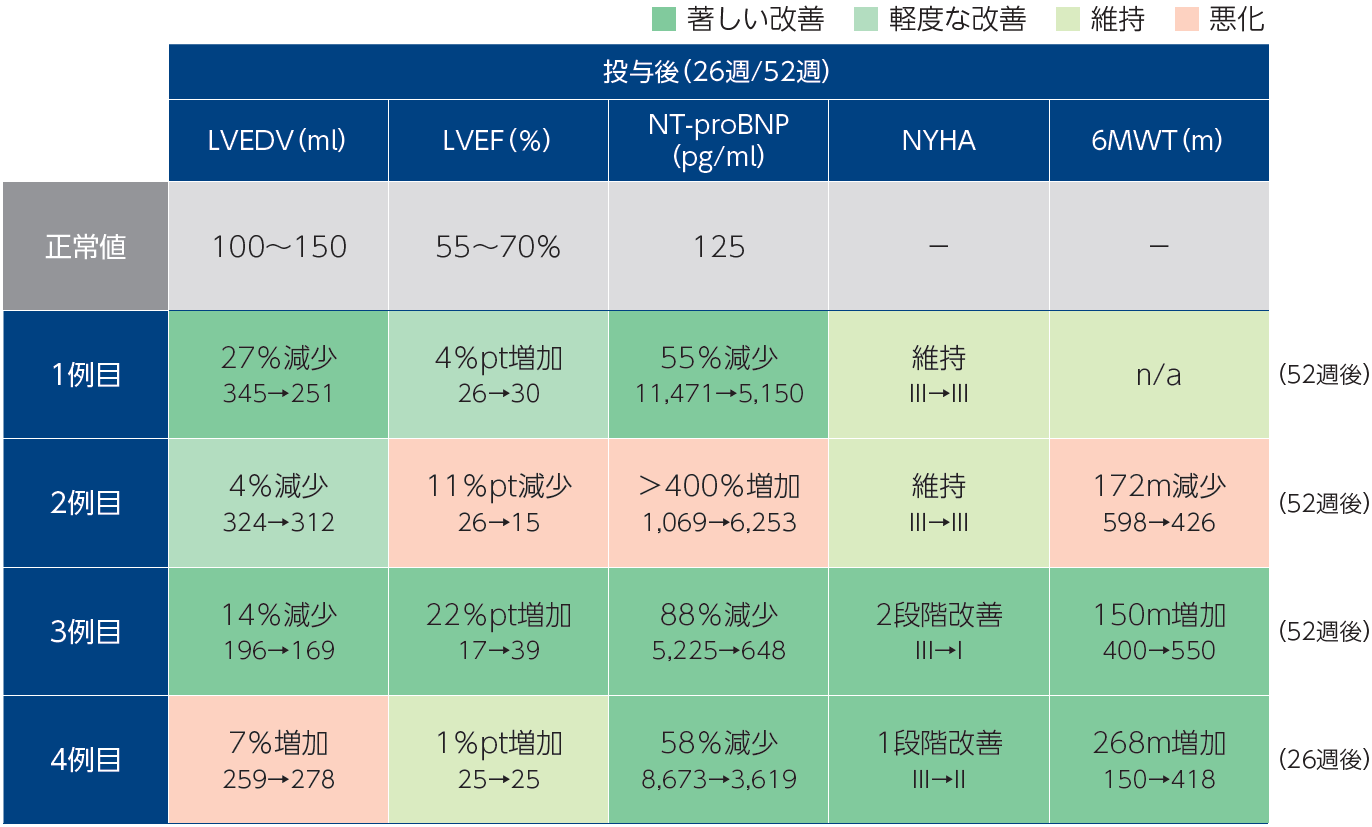
注:心エコーによる治験施設における判定
事業のバリューチェーン
当社事業におけるバリューチェーンは、研究、開発、製造、輸送、販売から構成されます。研究において当社は、大学病院や公的研究機関や企業等の開発パートナーとの共同研究等を通じて、心筋再生に関する最先端の研究を遂行しております。そしてこれら研究成果を、特許として出願することにより知的財産を形成しております。
当社は他家iPS細胞由来心筋球による心筋再生医療の海外展開を視野に入れ、2021年5月に、デンマークに本社を置くグローバル大手製薬企業であるノボノルディスク エー・エスと、全世界を対象とする独占的技術提携・ライセンス契約を締結いたしました。本契約は、HS-001やHS-005を含む他家iPS細胞由来心筋球(細胞株、投与方法、適応症は問わない)の日本以外の全世界における臨床開発・製造・販売権をノボノルディスク エー・エスへと付与する一方、国内では当社が製造販売権を保持して、両者共同で商業化(co-commercialize)し、日本国内事業に関する収益を50:50にてプロフィットシェアする事業提携スキームとなっております。これにより当社の事業収益は、日本国内で薬事承認後に取得する収益に加えて、導出に係る契約一時金(2021年に受領済)、日本及び海外の開発進捗に応じたマイルストン収入(一部受領済)、並びに海外での製品上市後のロイヤルティ収入及び販売マイルストン収入から構成されます。契約一時金および各種マイルストン収入は最大で合計598百万米ドルとなり、海外で販売開始後は、海外年間純売上高に応じて漸増する1桁後半~2桁前半パーセントのロイヤルティ収入も受領いたします。
日本国内の開発については、当社単独で進めており、開発業務受託機関(CRO)の支援を得て治験実施中です。治験において、治験製品の製造については、開発製造受託機関(CDMO)である(株)ニコン・セル・イノベーションへ、また、心筋球や移植針などの移植デバイスの輸送は再生医療に実績のある(株)メディパルホールディングスの100%子会社であるSPLine(エスピーライン)(株)へ委託しております。

本サイトはIR広告であり、Heartseed株式会社から提供を受けた資料をもとに掲載しておりますが、本広告を以って楽天証券が特定の銘柄の売買を推奨するものではありません。 掲載内容は、今後、告知なく変更される可能性があり、また最新の情報でない可能性があります。IRに関する最新情報は、企業のホームページをご確認ください。
本コンテンツは情報の提供を目的としており、投資その他の行動を勧誘する目的で、作成したものではありません。銘柄の選択、売買価格等の投資の最終決定は、お客様ご自身でご判断いただきますようお願いいたします。本コンテンツの情報は、弊社が信頼できると判断した情報源から入手したものですが、その情報源の確実性を保証したものではありません。本コンテンツの記載内容に関するご質問・ご照会等には一切お答え致しかねますので予めご了承お願い致します。また、本コンテンツの記載内容は、予告なしに変更することがあります。
